微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 向100mL18mol/L的H2SO4溶液中加入足量的铁片加热。充分反应后,产生的气体在标准状况下的体积为(提示:2Fe+6H2SO4(浓)  Fe2(SO4)3+SO2↑+6H2O)。
Fe2(SO4)3+SO2↑+6H2O)。
A.小于20. 16 L
B.等于20. 16 L
C.介于20. 16 L和40. 32 L之间
D.等于40. 32 L
参考答案:C
本题解析:
试题分析:足量的铁和浓硫酸反应,随反应进行,浓硫酸浓度会降低。采用极限法,若全部生成SO2,则气体体积为20.16L,若全部生成H2,则气体体积为40.16L,所以C正确。
本题难度:一般
2、选择题 北京市为了降低燃煤产生SO2的排放量,采取了许多有力的措施。措施之一是推广使用低硫煤,并向煤中加入石灰石,该方法可减少SO2的排放,此法称为“钙基固硫”。这种煤燃烧后,大部分硫元素最终存在形式为
A.CaSO4
B.CaSO3
C.CaS
D.SO3
参考答案:A
本题解析:
试题分析:钙基固硫过程中发生的反应:CaO+SO2=CaSO3,2CaSO3+O2=2CaSO4,所以硫元素主要以CaSO4形式存在。答案选A。2的性质
点评:本题比较基础,难度较小。
本题难度:简单
3、选择题 下列有关物质的性质和应用叙述正确并且有因果关系的是
A.烧碱具有碱性,能用于治疗胃酸过多
B.焦炭具有还原性,一定条件下能将二氧化硅还原为硅
C.浓硝酸具有强氧化性,能和浓氨水反应产生白烟
D.二氧化硫具有漂白性,与氯水混合使用漂白效果更好
参考答案:B
本题解析:
试题分析:A、烧碱碱性太强具有腐蚀性,不能用于治疗胃酸过多,A不正确;B、焦炭具有还原性,一定条件下与二氧化硅反应生成硅和CO,B正确;C、浓硝酸易挥发,与氨水挥发出的氨气结合生成硝酸铵而冒白烟,与浓硝酸的氧化性无关系,C不正确;D、二氧化硫具有还原性,与氯气混合生成盐酸和硫酸,漂白性减弱甚至消失,D不正确,答案选B。
本题难度:一般
4、填空题 某研究小组利用题9图装置探究铜与浓硫酸反应的产物。
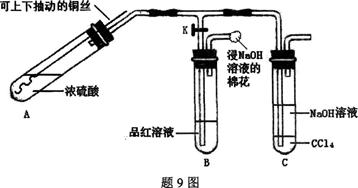
实验步骤与现象如下:
①检查装置气密性,向A中加入5 mL浓硫酸,打开K,将铜丝伸入浓硫酸中,给A处加热,观察到B中品红溶液褪色,再关闭K。
②实验观察到A中液面下铜丝变黑,产生气泡,液面上方产生大量白雾,一段时间后溶液中有白色固体出现,拉出铜丝,停止加热。回答下列问题:
(1)溶液中白色固体是???????(填化学式),C中CCl4的作用是?????????????。
(2)取出铜丝,用蒸馏水洗净后伸入到稀硫酸中,铜丝变亮、溶液变蓝。写出A中可能发生反应的化学方程式:????????????????????、????????????????????。
(3)分离出C中的上层液体,滴加过量稀盐酸和BaCl2溶液,有白色沉淀产生。
①分离的操作名称为:?????????????:
②白色沉淀为:?????????????;
③产生白色沉淀的原因可能是??????????????????。
参考答案:(1)CuSO4;防倒吸;
(2)Cu+H2SO4(浓
本题解析:
试题分析:(1)浓硫酸在加热时发生反应Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O。由于在浓硫酸中水很少,所以得到是无水硫酸铜CuSO4,颜色为白色。SO2有漂白性,能使某些有色物质如品红变为无色,因此装置B的品红溶液变为无色。SO2是酸性氧化物,能与NaOH发生反应:SO2+2NaOH=Na
CuSO4+SO2↑+2H2O。由于在浓硫酸中水很少,所以得到是无水硫酸铜CuSO4,颜色为白色。SO2有漂白性,能使某些有色物质如品红变为无色,因此装置B的品红溶液变为无色。SO2是酸性氧化物,能与NaOH发生反应:SO2+2NaOH=Na
本题难度:一般
5、填空题 某化学小组进行Na2SO3的性质实验探究。
在白色点滴板的a、b、c三个凹槽中滴有Na2SO3溶液,再分别滴加下图所示的试剂:
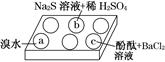
实验现象如下表:
编号
| 实验现象
|
a
| 溴水褪色
|
b
| 产生淡黄色沉淀
|
c
| 滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去
?
根据实验现象进行分析:
(1)a中实验现象证明Na2SO3具有________性。
(2)b中发生反应的离子方程式是_____________________________________________
(3)应用化学平衡原理解释c中现象(用化学用语及简单文字表述)__________________________________________________________。
参考答案:(1)还原性 (2)SO32-+2S2-+6H+=3S↓+3
本题解析:(1)a中发生反应的化学方程式为:Na2SO3+Br2+H2O=Na2SO4+2HBr,证明Na2SO3具有还原性。
(2)b中产生淡黄色沉淀,发生反应的离子方程式是SO32-+2S2-+6H+=3S↓+3H2O。
(3)滴入酚酞溶液变红是因为SO32-发生了水解反应而使溶液显碱性:SO32-+H2O??HSO3-+OH-,再加入BaCl2溶液后,Ba2+与SO32-反应产生BaSO3沉淀,反应消耗了SO32-使其浓度减小,水解平衡向左移动,OH-浓度减小,红色褪去。
本题难度:一般
|