微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 物质燃烧时产生飘尘与空气中的SO2、O2接触时,SO2会部分转化为SO3,使空气的酸度增加。飘尘所起的主要作用是
A.氧化剂
B.还原剂
C.催化剂
D.吸附剂
参考答案:C
本题解析:2SO2+O2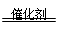 2SO3,飘尘所起的主要作用是催化剂,选C。
2SO3,飘尘所起的主要作用是催化剂,选C。
本题难度:一般
2、选择题 银耳本身为淡黄色,福建省出产一种雪耳,颜色洁白如雪。其制作过程如下:将银耳堆放在密封状况良好的塑料棚内,在棚的一端支一口锅,锅内放硫黄,加热使硫磺熔化并燃烧,两天左右,雪耳就制成了。雪耳炖不烂,且对人有害。制作雪耳利用的是(??? )
A.硫的还原性
B.硫的漂白性
C.二氧化硫的还原性
D.二氧化硫的漂白性
参考答案:D
本题解析:硫易燃,产生的气体二氧化硫具有漂白性。有些不法商贩常用此性质来漂白馒头。
本题难度:简单
3、选择题 足量的锌和下列酸反应,产生H2的物质的量最多的是
A.10mL 18.4mol/L H2SO4
B.30mL 3mol/L盐酸
C.30mL 2mol/L H2SO4
D.30mL 5mol/L HNO3
参考答案:C
本题解析:略
本题难度:简单
4、实验题 (10分)下表是某城市某日的空气质量报告:
污染指数
| 首要污染物
| 空气质量级别
| 空气质量状况
|
55
| SO2
| II
| 良
该市某校研究性学习小组对表中首要污染物SO2导致酸雨的成因进行了如下探究:
[探究实验一]用下图所示装置进行实验。
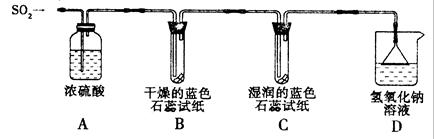
① A装置的作用是?????(填“干燥”或“氧化”)SO2气体。
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变???色,说明SO2与水反应生成一种酸。
③ D装置的作用是?????????,D中发生反应的化学方程式是?????????????。
[探究实验二]往盛有水的烧杯中通入SO2气体,测得所得溶液的pH?????7(填“>”“=”或“<”),然后每隔1 h测定其pH,发现pH逐渐?????(填“变大”或“变小”),直至恒定。说明烧杯中的溶液被空气中的氧气氧化最终生成H2SO4。
[查阅资料]SO2形成酸雨的另一途径为:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4。则在此过程中的飘尘是作为?????(填“催化剂”或“氧化剂”)。
[探究结论]SO2与空气中的氧气、水反应生成硫酸而形成酸雨。该市可能易出现酸雨。
[知识拓展]
(1)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为?????,是造成酸雨的另一主要原因。
(2)该市某工厂的燃料煤中硫的质量分数为0.16%,该工厂每天燃烧这种煤100吨。如果煤中的硫全部转化为SO2,那么这些SO2在标准状况下的体积约为?????m3。
参考答案:(共10分,每空1分,最后一空2分)
[探究实验一]干
本题解析:[探究实验一]考查了二氧化硫的干燥、漂白性、尾气吸收。
[探究实验二]二氧化硫为酸性氧化物,可表现还原性
SO2+H2O=H2SO3????? 2H2SO3 +O2=2H2SO4
[知识拓展](2)????? S???? ??SO2 ??SO2
_???????????? 32×10—6 t?????
本题难度:一般
5、选择题 下列变化的实质相似的是: ????????????
A.浓H2SO4和浓HCl在空气中敞口放置时浓度均减小.
B.SO2和Cl2均能使品红溶液褪色.
C.浓H2SO4和稀硫酸与锌反应均生产气体.
D浓H2SO4、浓HNO3均可以用铁制容器贮存.
参考答案:D
本题解析:
正确答案:D
A.不正确,浓H2SO4和浓HCl在空气中敞口放置时浓度均减小,因为浓硫酸具有吸水性,浓盐酸具有挥发性.
B.不正确,SO2和Cl2均能使品红溶液褪色,SO2与某些有机有色物质化合生成不稳定的无色物质,Cl2与水反应生成HClO具有强氧化性将品红氧化成无色物质。
C.不正确,浓H2SO4和稀硫酸与锌反应均生产气体,浓H2SO4具有强氧化性,生成SO2;稀硫酸与锌生成H2
D,正确。
本题难度:简单
|