微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (16分)硫酸是一种实验室常用的化学试剂。请按要求填空:
(1)浓硫酸试剂瓶上适合贴上的图标是??????????????(填写字母标号)。

(2)实验室有1.00mol·L-1的硫酸溶液,从中准确量出10.00 mL,其物质的量浓度为?????mol·L-1。现将准确量出的10.00 mL的硫酸溶液配制成0.100mol·L-1的稀硫酸,所需要的玻璃仪器除烧杯、玻璃棒还需?????和???????。
(3)用图所示的实验装置验证铜与浓硫酸反应生成的气体产物,则装置②、③分别为???????????。

A.品红溶液? B.BaCl2溶液? C.NaOH溶液? D.AgNO3溶液
(4)装置①中发生反应的化学方程式为?????????????????????????????????????,
若装置①中加入铜6.4g和含有0.2molH2SO4的浓硫酸,则产生二氧化硫质量?????????????
A.等于6.4克?????? B.大于6.4克 ????? C.小于6.4克 ????? D.不能确定
(5)若将装置①中的铜片换成木炭,装置②试管内为品红溶液, 装置③试管内为澄清石灰水,则装置①中发生反应的化学方程式为??????????????????。装置②中的现象是??????????????????。根据装置③观察到有白色沉淀生成的现象 ,?????????(填“能”或“不能”)判断该白色沉淀一定只有CaCO3。
参考答案:(共16分)
(1)C(1分) (2) 1.00(1分
本题解析:
试题分析:(1)浓硫酸具有强氧化性,有很强的腐蚀性。(2)在同一个溶液中的浓度是相等的。配置溶液需要的仪器有,烧杯、玻璃棒、胶头滴管、100mL容量瓶。(3)②中验证SO2用的是品红溶液。③中是进行尾气吸收用的是NaOH溶液。(4)①中发生的是铜和浓硫酸的反应,方程式为:Cu+2H2SO4(浓)="==" CuSO4+SO2↑+2H2O,因为浓硫酸反应过程中浓度越来越稀,到最后呈稀硫酸就不和铜反应了,故产生二氧化硫质量小于6.4克。(5)①中发生的是炭和浓硫酸的反应,方程式为:C+2H2SO4(浓
本题难度:一般
2、选择题 下列关于SO2性质的分析,肯定错误的是
A.通入Ca(ClO)2溶液中,有HClO生成
B.通入FeCl3溶液中,有SO42-生成
C.通入氯水中,有淡黄色沉淀生成
D.通入KICl2溶液中,有I-生成
参考答案:C
本题解析:
试题分析:A、Ca(ClO)2+SO2(少量)+H2O=CaSO4↓+HCl+HClO;Ca(ClO)2+2SO2(过量)+2H2O=CaSO4↓+2HCl+H2SO4 ;通入Ca(ClO)2溶液中,可能有HClO生成,故A正确; B、二氧化硫通入FeCl3溶液中,发生反应,2Fe3++SO2+H2O=2Fe2++4H++SO42-,有SO42-生成,故B正确; C、通入氯水中反应,Cl2+SO2+2H2O=H2SO4+2HCl,无淡黄色沉淀生成,故C错误; D、二氧化硫气体通入KICl2溶液中,
本题难度:一般
3、判断题 酸雨主要是大量燃烧含硫燃料释放出SO2所造成的,试回答下列问题:
(1)现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下:
测试时间/h
| 0
| 1
| 2
| 3
| 4
|
雨水的pH
| 4.73
| 4.62
| 4.56
| 4.55
| 4.55
分析数据,回答下列问题:
①雨水样品的pH变化的原因是(用化学方程式表示)_______________。
②如果将刚取样的上述雨水和自来水相混合,pH将变______,原因是(用化学方程式表示)___________________。
(2)你认为减少酸雨产生的途径可采用的措施是______________。
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③
B.②③④⑤
C.①③⑤
D.①③④⑤
(3)有人在英国进行的一项研究结果表明:高烟囱可以有效地降低地表面SO2浓度.在20世纪的60~70年代的10年间,由发电厂排放出的SO2增加了35%,但由于建筑高烟囱的结果,地面浓度降低了30%之多.请你从全球环境保护的角度,分析这种方法是否可取?简述其理由.
参考答案:(1)①SO2+H2O 本题解析:(1)酸雨放置时pH变小,其原因是雨水中的H2SO3被空气中氧气氧化所致.雨水和自来水混合,应考虑H2SO3与Cl2(或HClO)的反应. 本题解析:(1)酸雨放置时pH变小,其原因是雨水中的H2SO3被空气中氧气氧化所致.雨水和自来水混合,应考虑H2SO3与Cl2(或HClO)的反应.
(2)减少酸雨的形成须减少SO2的排放,将煤转化为清洁能源(如煤的气化和液化),燃料脱硫、固硫,开发不含硫的新能源(如氢能、核能等),都是有力措施。
(3)将烟囱建高,并没有减少SO2的排放,只是将SO2在地表的含量降了下来,无疑将增加高空中SO2的浓度,酸雨依旧会形成.
本题难度:简单
4、实验题 某校化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数,并探究铁与浓硫酸的反应。
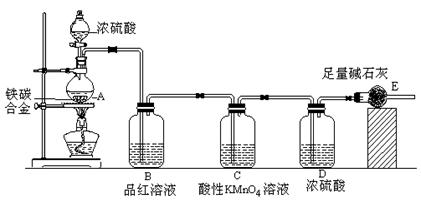
(1)m克铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是①常温下碳与浓硫酸不反应;②???????????????????。
(2)写出加热时A中碳与浓硫酸发生反应的化学方程式????????????????????。
(3)B中的现象是:???????????????????????????????????????????????????;
C的作用是:?????????????????????????????????????????????????????。
(4)待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg。则铁碳合金中铁的质量分数为??????(写含m、b的表达式)。
⑸反应一段时间后,用滴管吸取A中的溶液滴入到适量水中作为试样,试样中所含金属离子的成分有以下三种可能:
A:只含有Fe3+;B:只含有Fe2+;C:???????????????????????????????????。
验证C的实验方法是??????????????????????????????????????????????????????
???????????????????????????????????????????????????????????。
参考答案:(1)?常温下Fe遇浓硫酸发生钝化??(1分)
(2)
本题解析:
试题分析:(1)依据铁在常温下在浓硫酸中钝化,碳和浓硫酸需要加热反应分析可知,往铁碳合金中加入浓硫酸,未点燃酒精灯前,A、B均无明显现象。
(2)碳和浓硫酸加热反应生成二氧化碳、二氧化硫和水,则化学方程式为 C+2H2SO4(浓) CO2↑+2SO2↑+2H2O, CO2↑+2SO2↑+2H2O,
(3)气体中含有二氧化硫,通过
本题难度:困难
5、填空题 某化学小组进行Na2SO3的性质实验探究。
在白色点滴板的a、b、c三个凹槽中滴有Na2SO3溶液,再分别滴加下图所示的试剂:
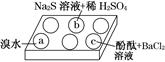
实验现象如下表:
编号
| 实验现象
| a
| 溴水褪色
| b
| 产生淡黄色沉淀
| c
| 滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去
?
根据实验现象进行分析:
(1)a中实验现象证明Na2SO3具有________性。
(2)b中发生反应的离子方程式是_____________________________________________
(3)应用化学平衡原理解释c中现象(用化学用语及简单文字表述)__________________________________________________________。
参考答案:(1)还原性 (2)SO32-+2S2-+6H+=3S↓+3
本题解析:(1)a中发生反应的化学方程式为:Na2SO3+Br2+H2O=Na2SO4+2HBr,证明Na2SO3具有还原性。
(2)b中产生淡黄色沉淀,发生反应的离子方程式是SO32-+2S2-+6H+=3S↓+3H2O。
(3)滴入酚酞溶液变红是因为SO32-发生了水解反应而使溶液显碱性:SO32-+H2O??HSO3-+OH-,再加入BaCl2溶液后,Ba2+与SO32-反应产生BaSO3沉淀,反应消耗了SO32-使其浓度减小,水解平衡向左移动,OH-浓度减小,红色褪去。
本题难度:一般
|
|