微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在Na2S溶液中c(Na+)与c(S2-)的比值是
A.2
B.小于2
C.大于2
D.1/2
参考答案:C
本题解析:
试题分析:
若S2-不水解,则c(Na+)与c(S2-)的比值等于2。但在实际Na2S溶液中,S2-容易水解(分步水解): S2-+H2O HS- +OH-,HS-+ H2O
HS- +OH-,HS-+ H2O H2S+OH- ,所以c(Na+)与c(S2-)的比值大于2。
H2S+OH- ,所以c(Na+)与c(S2-)的比值大于2。
考点:考查盐类的水解
点评:本题考查了盐类的水解,离子浓度大小的比较,难度不大。解题时注意S2-水解,导致c(S2-)比c(Na+)的1/2还要小。
本题难度:一般
2、填空题 (6分)
(1)下列化学原理的应用,主要用沉淀溶解平衡原理来解释的是 :
①热纯碱溶液洗涤油污的能力比冷纯碱溶液强;②误将钡盐[BaCl2、Ba(NO3)2]当作食盐食用时,常用0.5%的Na2SO4溶液解毒;③石灰岩(喀斯特地貌)的溶洞形成;④BaCO3不能做“钡餐”,而BaSO4则可以;⑤使用泡沫灭火器时“泡沫”生成的原理。
A.②③④
B.①②③
C.③④⑤
D.①②③④⑤
(2)氯化铝水溶液呈 性 ,其离子方程式表示为 ;
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
参考答案:(1)A (2)酸 Al3+ +3H2O
本题解析:
试题分析:①热纯碱溶液洗涤油污的能力比冷纯碱溶液强是因为纯碱是强碱弱酸盐,水解使溶液显碱性。而盐的水解反应是吸热反应,所以升高温度促进盐的水解,因此去污能力强。与沉淀溶解平衡无关,错误;②误将钡盐[BaCl2、Ba(NO3)2]当作食盐食用时,若服用0.5%的Na2SO4溶液,就会发生沉淀反应产生BaSO4沉淀,降低了人体内的Ba2+的浓度,从而达到解毒的目的,这与沉淀溶解平衡有关,正确;③当水中含有CO2等酸性气体时就会发生反应产生容易溶解于水碳酸氢盐,随水分而流失,从而促进了盐的溶解和电离,盐再溶解,最后逐步形成石灰岩(喀斯特地貌)的溶洞;这与沉淀溶解平衡有关,正确;⑤使用泡沫灭火器时是盐的双水解反应相互促进,产生更多的Al(OH)3,在CO2的气体压力作用下以泡沫的形式出现,“泡沫”生成的原理与沉淀溶解平衡无关,错误。故正确的说法是②③④,故选项是A。(2)氯化铝是强酸弱碱盐,若碱根离子水解消耗水电离产生的OH-,最终当溶液处于平衡时, c(H+)>c(OH-),所以溶液呈酸性;水解的离子方程式表示为Al3+ +3H2O Al(OH)3+3H+ 。水解产生的HCl会随着水分的蒸发而挥发,所以蒸干得到的固体是Al(OH)3,若再灼烧,则Al(OH)3发生分解反应产生Al2O3和水,所以最后得到的主要固体产物是Al2O3。
Al(OH)3+3H+ 。水解产生的HCl会随着水分的蒸发而挥发,所以蒸干得到的固体是Al(OH)3,若再灼烧,则Al(OH)3发生分解反应产生Al2O3和水,所以最后得到的主要固体产物是Al2O3。
考点:考查盐的水解平衡、沉淀溶解平衡及盐水解的应用的知识。
本题难度:一般
3、选择题 某有机物的结构简式如图,它在一定条件下可能发生的反应类型是( )
①加成??②水解??③酯化??④消去??⑤中和??⑥氧化??⑦还原.
A.①③④⑤⑥⑦
B.①③④⑤⑦
C.①③⑤⑥⑦
D.②③④⑤⑥
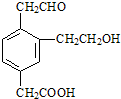
参考答案:A
本题解析:
本题难度:一般
4、选择题 某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是
A.该溶液可由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成
B.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
C.加入适量的NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH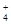 )之和
)之和
参考答案:A
本题解析:
试题分析:A.由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成的溶液,电离的CH3COOH与NaOH反应,仍可以继续电离使溶液呈酸性,且溶液中只有Na+、CH3COO-、H+、OH-四种离子;B.由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成,CH3COOH与NaOH恰好反应生成CH3COONa,溶液水解呈碱性;C.溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+)不满足电荷守恒;D.加入大量的氨水,c(NH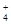 )>c(CH3COO-),不正确。
)>c(CH3COO-),不正确。
考点:溶液中的离子及其浓度。
本题难度:一般
5、选择题 下列溶液中微粒的物质的量浓度关系正确的是
A.25℃时,pH=7的NH4Cl与NH3·H2O混合溶液:c(H+)= c(OH-)= c(NH4++)=c(Cl-)
B.0.1mol/LNa2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S)
C.25℃时,pH=2的HCOOH与pH=12的NaOH等体积混合:c(HCOO-)+ c(H+)>c(Na+)+c(OH-)
D.0.1mol/LNa2CO3溶液与0.1mol/L NaHCO3溶液等体积混合:2c(CO32-)+2c(HCO3-)+2c(H2CO3)=3c(Na+)
参考答案:CD
本题解析:
试题分析:A、25℃时,pH=7的NH4Cl与NH3·H2O混合溶液呈中性,则有c(H+)=c(OH-),由电荷守恒式:c(H+)+ c(NH4+)= c(OH-)+ c(Cl-)知c(NH4+)=c(Cl-),又弱电解质的电离和盐类的水解是微弱的则c(NH4+)=c(Cl-)> c(H+)=c(OH-),错误;B、0.1mol/LNa2S溶液中,根据质子守恒知c(OH-)=c(H+)+c(HS-)+2c(H2S),错误;C、25℃时,pH=2的HCOOH与pH=12的NaOH溶液中,c(HCOOH)>c(NaOH),等体积混合后HCOOH远过量,溶液为HCOOH和CH3COONa,呈酸性,结合电荷守恒式知c(HCOO-)+c(H+)>c(Na+)+c(OH-),正确;D、根据物料守恒得2c(CO32-)+2c(HCO3-)+2c(H2CO3)=3(Na+),正确。
考点:考查溶液中离子浓度的大小关系及守恒规律的应用。
本题难度:困难