微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知:合成氨是一个放热反应,下列事实不能用勒沙特列原理来解释的是( )
A.加压有利于SO2与O2反应生成S03
B.500℃左右比常温下更有利于合成氨
C.将混合气中的氨气液化,有利于合成氨的反应
D.用过量空气煅烧硫铁矿可以提高原料的利用率
参考答案:A.存在平衡2SO2+O2(g)?2SO3(g),正反应为气
本题解析:
本题难度:一般
2、填空题 水煤气转化反应CO(g)+H2O(g)  CO2(g)+H2 (g)在一定温度下达到化学平衡状态。
CO2(g)+H2 (g)在一定温度下达到化学平衡状态。
完成下列填空:
(1)写出该反应的平衡常数表达式K=________________。
(2)一定温度下,在一个容积不变的密闭容器中发生上述反应,下列说法中能判断该反应达到化学平衡状态的是 (选填编号)。
a.容器中的压强不变 b.1 mol H-H键断裂的同时断裂2 molH-O键
c.v正(CO) = v逆(H2O) d.c(CO) = c(H2)
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下实验组1和实验组2的数据:
实验组
| 温度/℃
| 起始量/mol
| 平衡量/mol
| 达到平衡所需时间/min
|
H2O
| CO
| H2
| CO
|
1
| 650
| 2
| 4
| 1.6
| 2.4
| 3
|
2
| 650
| 1
| 2
| 0.8
| 1.2
| 5
|
3
| 950
| 1
| 2
| —
| —
| —
①由实验组1的数据可知,平衡时CO的转化率为 %。
②由实验组1和2的数据可分析,压强对该可逆反应的影响是 。
③有了实验组1和2的数据,再设计实验组3,其目的是 。
参考答案:(1) 本题解析: 本题解析:
试题分析:(1)可逆反应CO(g)+H2O(g)?CO2(g)+H2 (g)的化学平衡常数k= ; ;
(2)a.反应前后气体的物质的量不发生变化,容器中始终压强不变,不能说明反应到达平衡,故A错误; b.l molH-H键断裂的同时断裂2mol H-O键,断裂2mol H-O键同时生成l molH-H键,说明反应到达平衡,故B正确; c.根据反应可知,自始至终v正(CO)=v正(H2O),若v正(CO)=v逆(H2O),则v正(H2O)=v逆(H2O),说明反应到达平衡,故C正确; d.根据反应可知,自始至终c(CO)=c(H2),不能说明反应到达平衡,故D错误;故选:bc;
(3)①、由表中数据可知,实验1组3min到达平衡,平衡时CO的物质的量变化量为4mol-2.4mol=1.6mol,故CO的转化率为1.6/4×100%=40%,故答案为:40;
②、由表中数据可知,实验1组压强为实验2组的2倍,实验1组压强增大到达平衡时缩短,故增大压强反应速率加快,平衡时各组分的物质的量为实验2组的2倍,增大压强反应物转化率不变,化学平衡不移动,故答案为:增大压强反应速率加快;增大压强反应物转化率不变,化学平衡不移动;
③、根据控制变量法分析,实验3与实验1、2组相比温度升高,压强对平衡不影响,故应是探究温度对该反应平衡的影响,对反应速率的影响,
故答案为:探究温度对该反应平衡的影响,对反应速率的影响.
考点:本题考查化学平衡常数、化学平衡状态的判断、化学平衡有关计算、化学平衡的影响因素等,难度不大,注意利用控制变量法探究外界条件对反应速率、化学平衡的影响.
本题难度:困难
3、选择题 在一密闭烧瓶中,在25℃时存在着平衡:2NO2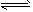 N2O4(正反应放热)。把烧瓶置于100℃的水中,则下列几项性质中不会改变的是 N2O4(正反应放热)。把烧瓶置于100℃的水中,则下列几项性质中不会改变的是
[???? ]
①颜色 ②平均相对分子质量 ③质量 ④压强 ⑤密度
A.③和⑤
B.②和④
C.④和⑤
D.①和③
参考答案:A
本题解析:
本题难度:一般
4、填空题 在密闭容器中进行可逆反应: CO(g)+NO2(g)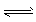 CO2(g)+NO(g),(正反应放热),达到平衡后,只改变其中一个条件,对平衡的影响是: CO2(g)+NO(g),(正反应放热),达到平衡后,只改变其中一个条件,对平衡的影响是:
①增大容器的体积,平衡___________移动(填“正向”“逆向”“不”),反应混合物的颜色_________。
(填“变深”“变浅”“不变”)
②容器体积不变:若通入CO2气体,平衡________移动,反应混合物的颜色__________。若通入N2气体,平衡________移动,反应混合物的颜色__________。
③加入催化剂,平衡____________移动。
参考答案:① 不移动;变浅 。
②逆向 ;变深;不移动;不变?
本题解析:
本题难度:一般
5、选择题 将2.5 mol A和1.25 mol B通入容积为1L的真空密闭容器中,经5s达到平衡状态。3A(g)+B(g)
参考答案:
本题解析:
本题难度:一般
|