微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 可逆反应在一定条件下达到反应限度(化学平衡状态)的标志是[???? ]
A.反应停止了
B.正反应速率与逆反应速率均为零
C.反应物和生成物浓度相等
D.正反应速率与逆反应速率相等
2、简答题 在80℃时,将0.40mol的N2O4气体充入1L固定容积的密闭容器中发生反应:N2O4═2NO2(△H>0),每隔一段时间对容器内的物质进行测定,得到如下数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100
n(N2O4)(mol)
0.40
a
0.20
c
d
e
n(NO2)(mol)
0.00
0.24
b
0.52
0.60
0.60
(1)在20s-40s之间,用N2O4表示的平均反应速率为______.
(2)在80℃时该反应的平衡常数K=______.
(3)要增大该反应的平衡常数,可采取的措施有(填序号)______.
①增大N2O4的起始浓度????????????②向混合气体中通入NO2
③使用高效催化剂????????????????④升高温度
(4)反应进行至100s后若降低温度,混合气体的颜色______(填“变浅”、“变深”或“不变”).
(5)反应进行至100s后若向容器中再充入0.40mol的N2O4气体,则达到新平衡后N2O4的转化率将______(填“增大”、“减小”或“不变”).
3、填空题 (13分)氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
反应
| 大气固氮
N2 (g)+O2 (g)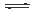 2NO(g) 2NO(g)
| 工业固氮
N2 (g)+3H2 (g) 2NH3(g) 2NH3(g)
| 温度/℃
| 27
| 2000
| 25
| 400
| 450
| K
| 3.84×10-31
| 0.1
| 5×108
| 0.507
| 0.152
①分析数据可知:大气固氮反应属于__________(填“吸热”或“放热”)反应。
②分析数据可知:人类不适合大规模模拟大气固氮的原因__________。
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因_______________________。
|
网站客服QQ: 960335752 - 14613519 - 791315772
|