微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 可逆反应在一定条件下达到反应限度(化学平衡状态)的标志是[???? ]
A.反应停止了
B.正反应速率与逆反应速率均为零
C.反应物和生成物浓度相等
D.正反应速率与逆反应速率相等
参考答案:D
本题解析:
本题难度:简单
2、简答题 在80℃时,将0.40mol的N2O4气体充入1L固定容积的密闭容器中发生反应:N2O4═2NO2(△H>0),每隔一段时间对容器内的物质进行测定,得到如下数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100
n(N2O4)(mol)
0.40
a
0.20
c
d
e
n(NO2)(mol)
0.00
0.24
b
0.52
0.60
0.60
(1)在20s-40s之间,用N2O4表示的平均反应速率为______.
(2)在80℃时该反应的平衡常数K=______.
(3)要增大该反应的平衡常数,可采取的措施有(填序号)______.
①增大N2O4的起始浓度????????????②向混合气体中通入NO2
③使用高效催化剂????????????????④升高温度
(4)反应进行至100s后若降低温度,混合气体的颜色______(填“变浅”、“变深”或“不变”).
(5)反应进行至100s后若向容器中再充入0.40mol的N2O4气体,则达到新平衡后N2O4的转化率将______(填“增大”、“减小”或“不变”).
参考答案:(1)生成0.24molNO2,消耗N2O4为0.12mol
本题解析:
本题难度:一般
3、填空题 (13分)氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
反应
| 大气固氮
N2 (g)+O2 (g)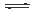 2NO(g) 2NO(g)
| 工业固氮
N2 (g)+3H2 (g) 2NH3(g) 2NH3(g)
| 温度/℃
| 27
| 2000
| 25
| 400
| 450
| K
| 3.84×10-31
| 0.1
| 5×108
| 0.507
| 0.152
①分析数据可知:大气固氮反应属于__________(填“吸热”或“放热”)反应。
②分析数据可知:人类不适合大规模模拟大气固氮的原因__________。
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因_______________________。
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,下图所示的图示中,正确的是________(填“A”或“B”);比较р1、р2的大小关系_________。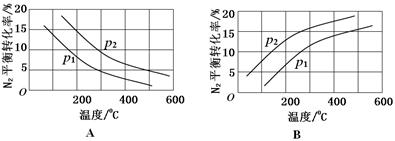 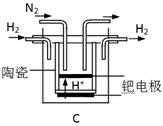
(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是_____________。
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1) 4NH3(g)+3O2(g),则其反应热ΔH=___________________。 4NH3(g)+3O2(g),则其反应热ΔH=___________________。
(已知:N2(g)+3H2(g) 2NH3(g) △H=-92.4kJ·mol-1 2NH3(g) △H=-92.4kJ·mol-1
2H2(g) +O2(g) 2H2O(l) △H=-571.6kJ·mol-1 ) 2H2O(l) △H=-571.6kJ·mol-1 )
参考答案:(1)①吸热(1分)
②K值小,正向进行的程度小(或转
本题解析:
试题分析:本题以氮的固定为背景考查原理性知识,通过K随温度的变化判断,大气固氮为吸热反应,而且270C时K值太小,化学反应进行的程度小,不适合大规模生产;人工固氮选择5000C左右,因为考虑到催化剂的活性;分析工业固氮的K随温度变化,确定为放热过程,所以A图正确,正反应为气体体积减小的反应,所以压强大N2的转化率高,所以р2>р1;利用电化学反应制取氨气,通入的氮气发生还原反应,且介质为酸性,从而写出电极反应式:N2+6e-+6H+ 2NH3;2N2(g)+6H2O(1) 2NH3;2N2(g)+6H2O(1) 4NH3(g)+3O2(g)可以由反应[(1)×2-(2)×3]得到,根据盖斯定律确定其ΔH=+1530kJ/mol. 4NH3(g)+3O2(g)可以由反应[(1)×2-(2)×3]得到,根据盖斯定律确定其ΔH=+1530kJ/mol.
考点:平衡常数的应用、化学平衡图像、原电池电极反应式的书写、盖斯定律。
本题难度:困难
4、计算题 (6分)在合成氨的生产中,将N2和H2按1:3的体积比充入合成塔,压强为20Mpa,从合成塔出来的气体中,氨气的体积分数为20%,若反应前后温度不变,试求:
(1)从合成塔出来的气体的压强是多少?
(2)平衡时,N2的转化率是多少?
参考答案:(1)16.67MPa
(2)33.33%
本题解析:略
本题难度:简单
5、填空题 (16分)为解决大气中CO2的含量增大的问题,某科学家提出“绿色自由”构想:把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,经化学反应使废气中的CO2转变为燃料甲醇。“绿色自由”构想的部分技术流程如下:

合成塔中反应的化学方程式为 ;△H<0。从平衡移动原理分析,低温有利于提高原料气的平衡转化率。而实际生产中采用300℃的温度,除考 虑温度对反应速率的影响外,还主要考虑了 。 虑温度对反应速率的影响外,还主要考虑了 。
从合成塔分离出甲醇的原理与下列 操作的原理比较相符(填字母)。
A.过滤
B.分液
C.蒸馏
D.结晶
(3)工业流程中一定包括“循环利用”,“循环利用”是提高效益、节能环保的重要措施。“绿色自由”构想技术流程中能够“循环利用”的,除K2CO3溶液和CO2、H2外,还包括 。
(4)在体积为2L的合成塔中,充入2 mol CO2和6 mol H2,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。从反应开始到平衡,v(H2) =______________;能使平衡体系中n(CH3OH)/n(CO2)增大的措施有 。

(5)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。
巳知CH4(g)+2O2(g)=" CO2(g)+2H2O(l)" ΔH1=-890.3kJ/mol
H2 (g)+ O2(g)=" H2O(l)" ΔH2=-285.8kJ/mol
写出CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式________________。
参考答案:(16分)
(1)CO2+3H2→ CH3OH+H2O
本题解析:略
本题难度:困难
|
|
网站客服QQ: 960335752 - 14613519 - 791315772
|