微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如图所示,将铁棒和石墨棒插入1 L 1 mol/L食盐水中。下列说法正确的是
 [???? ]
[???? ]
A.若开关K与N连接,铁被保护不会腐蚀
B.若开关K与N连接,正极反应式是4OH- - 4e- = 2H2O+O2↑
C.若开关K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜
D.若开关K与M连接,当两极共产生28 L(标准状况)气体时,生成了1 mol NaOH
参考答案:D
本题解析:
本题难度:一般
2、选择题 装置如图,通电后,发现Cu极附近溶液蓝色加深.下列说法正确的是( )
A.A极为负极,Cu为阳极
B.左烧杯溶液和右烧杯溶液pH都变小
C.左烧杯溶液浓度变大,右烧杯溶液浓度不变
D.左烧杯Pt极和右烧杯Fe极的电解产物物质的量之比为1:1
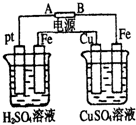
参考答案:A.通电后,发现Cu极附近溶液蓝色加深,说明铜电极失电子生成
本题解析:
本题难度:简单
3、填空题 (10分)如图为相互串联的甲乙两个电解池,请回答:
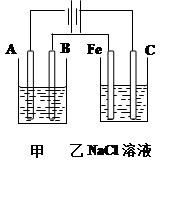
甲池若为用电解精炼铜的装置:
(1)A极电极反应为 ,
B极电极反应为_ _,
乙池中的总反应离子方程式为 。
(2)若甲槽阴极增重12.8g,则乙槽阴极放出气体在标准状况下的体积为 。
(3)若乙槽剩余液体为400mL,则电解后得到碱液的物质的量浓度为 。
参考答案:(10分) (1) Cu2+ + 2e
本题解析:
本题难度:一般
4、选择题 1 L某溶液中含有的离子如下表:
离子
| Cu2+
| Al3+
| NO
| Cl-
|
物质的量浓度(mol/L)
| 1
| 1
| a
| 1
用惰性电极电解该溶液,当电路中有3 mol e-通过时(忽略电解时溶液体积的变化及电极产物可能存在的溶解现象),下列说法正确的是( )
A.电解后溶液的pH=0 B.a=3
C.阳极生成1.5 mol Cl2 D.阴极析出的金属是铜与铝
参考答案:A
本题解析:根据电子守恒可知,该反应过程中涉及的反应有:阳极:2Cl--2e-=Cl2↑(产生氯气的体积,标准状况下为0.5 mol),4OH--4e-=2H2O+O2↑;阴极:Cu2++2e-=Cu,2H++2e-=H2↑。从电子守恒的角度知,电解后溶液的pH=0,A项正确;从电荷守恒的角度可知,a=4,B不正确。
本题难度:一般
5、填空题 (10分)图示的四个容器中分别盛有不同的溶液,除A、B外,其余电极均为石墨电极。甲为铅蓄电池,其工作原理为:Pb+PbO2+2H2SO4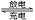 2PbSO4+2H2O,其两个电极的电极材料分别是PbO2和Pb。 2PbSO4+2H2O,其两个电极的电极材料分别是PbO2和Pb。
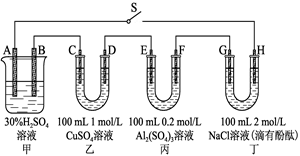
闭合S,发现G电极附近的溶液变红,20 min后,将S断开,此时C、D两极上产生的气体体积相同;据此回 答:
(1)A电极的电极材料是______________(填“PbO2”或“Pb”)。
(2)电解后,要使丙中溶液恢复到原来的浓度,需加入的物质是________(填化学式)。
(3)到20 min时,电路中通过电子的物质的量为________。
(4)0~20 min,H电极上发生反应的电极反应式为______________
参考答案:28(1)PbO2 (2) H2O (
本题解析:
试题分析:(1)闭合S,发现G电极附近的溶液变红,说明G的电极反应为2H2O+2e-=H2+2OH-,G为阴极,则H为阳极,A为正极,A电极的电极材料是PbO2;(2)丙中电解硫酸铝溶液,实际上是电解水,要使丙中溶液恢复到原来的浓度,需加入的物质是水;(3)20 min后,将S断开,此时C、D两极上产生的气体体积相同,设C、D产生气体的物质的量为xmol,
C极发生的电极反应为Cu2+ + 2e- =" Cu" 、2H+ + 2e- = H2↑,D极的电极反应为4OH— - 4e- = 2H2O + O2↑
0.1 0.2 2x x 4x x
0.2+2x="4x" 解得x="0.1" 则到20 min时,电路中通过电子的物质的量为0.4mol;
(4)0~20 min,H电极上发生反应的电极反应式为2Cl--2e-=Cl2↑;0.2moLCl-只放电0.2moL,随后是OH-放电,即4OH--4e-=O2+2H2O 。
考点:考查铅蓄电池,电解原理的应用。
本题难度:一般
|