微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如图装置中,小试管内为红墨水,带有支管的U型管中盛有pH=4的雨水和生铁片。经观察,装置中有如下现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于U型管中的液面。以下有关解释合理的是
 [???? ]
[???? ]
A.生铁片中的碳是原电池的负极,发生还原反应
B.雨水酸性较强,生铁片始终发生析氢腐蚀
C.墨水液面回升时,正极反应式为:O2+2H2O+4e-==4OH-
D.U型管中溶液pH逐渐减小
参考答案:C
本题解析:
本题难度:一般
2、填空题 (8分)已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。某化学兴趣小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。步骤一:电解精制:
请回答以下问题:电解时,阴极上的电极反应式为???????????????????;
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:
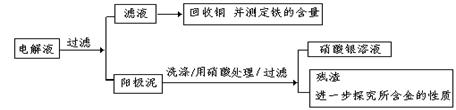
(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式:?????????????。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
序号
| 反应
| 平衡常数
|
1
| Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O
| << 1
|
2
| Au3+ + 4Cl— =? AuCl4—
| >>1
?
从中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1∶3的混合物),请你简要解释金能够溶于王水的原因:??????????????????????????????????????
(2)滤液含量的测定: 以下是该小组探究滤液的一个实验流程:
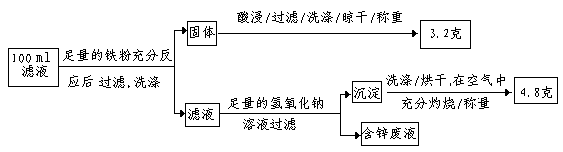
则100ml滤液中Fe2+的浓度为?????????mol·L-1
参考答案:步骤一: Cu2++2e = Cu? 3Ag + 4H+ +
本题解析:
试题分析:步骤一:电解精制铜。电解精炼铜时,以粗铜作阳极,以精铜作阴极,阳极发生氧化反应:Cu-2e-=Cu2+,阴极发生还原反应: Cu2+ +2e-=" Cu." (1)步骤二.粗铜中含有少量的锌、铁、银、金等金属.在铜在阳极被氧化为铜离子时,比铜活泼的锌、铁也被氧化成离子进入溶液。Zn-2e-=Zn2+;Fe-2e-=Fe2+。比铜弱的银、金则以固体的形式存在阳极的下面沉淀中。俗称阳极泥。稀硝酸和银反应的离子方程式:3Ag + 4H+ + NO3- = 3Ag+ + NO ↑+ 2H2O。金
本题难度:一般
3、选择题 某同学按图所示的装置进行电解实验。下列说法正确的是
 [???? ] [???? ]
A.电解过程中,铜电极上有H2产生
B.电解初期,主反应方程式为:Cu+H2SO4 CuSO4+H2↑ CuSO4+H2↑
C.电解一定时间后,石墨电极上也不可能有铜析出
D.整个电解过程中,H+的浓度不断增大
参考答案:B
本题解析:
本题难度:一般
4、选择题 由于Fe(OH)2极易被氧化,实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.若用下图实验装置可制得纯净的Fe(OH)2沉淀,两极材料分别为石墨和铁.下列有关叙述正确的是( )
A.a电极材料为石墨,电极反应式为2H++2e-=H2↑
B.液体c为苯或乙醇,作用是防止空气中氧气氧化Fe(OH)2
C.在加入液体c之前,需要对电解液d进行加热处理
D.电解液d若是NaOH溶液,则白色沉淀在电极附近生成;电解液d若是NaCl溶液,则白色沉淀在两电极之间的溶液中生成
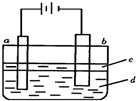
参考答案:A.a连接电源正极,为电解池的阳极,发生Fe-2e-=Fe2
本题解析:
本题难度:一般
5、选择题 500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是(? )
A.原混合溶液中c(K+)为1 mol·L-1
B.上述电解过程中共转移4 mol电子
C.电解得到的Cu的物质的量为0.5 mol
D.电解后溶液中c(H+)为2 mol·L-1
参考答案:B
本题解析:
试题分析:电解KNO3和Cu(NO3)2的混合溶液,在阳极发生反应:4OH—-4e-=2H2O+O2↑。n(O2)= 22.4 L÷22.4L/mol=1mol。则转移电子4mol.因此选项B正确;在阴极首先发生反应:Cu2++2e-=Cu,然后发生:2H++2e-=H2↑。由于产生氢气的物质的量是1mol,得到电子2mol,则产生Cu转移的电子也是2mol,产生Cu1mol。所以选项C错误;Cu(NO3)2的物质的量是1mol,根据N守恒可得n(KNO3)= 6.0 mol/L×0.5L-2mo
本题难度:一般
|