微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)工业上电解饱和食盐能制取多种化工原料,其中部分原料可用于制备多晶硅。
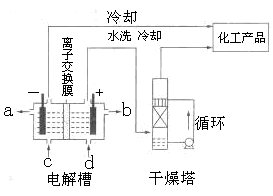
(1)下图是离子交换膜法电解饱和食盐水示意图,电解槽阳极产生的气体是????;NaOH溶液的出口为??????(填字母);精制饱和食盐水的进口为??????(填字母);干燥塔中应使用的液体是?????。
(2)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4的综合利用受到广泛关注。
① SiCl4可制气相白炭黑(与光导纤维主要原料相同),方法为高温下SiCl4与H2和O2反应,产物有两种,化学方程式为???????????????????????。
② SiCl4可转化为SiHCl3而循环使用。一定条件下,在20L恒容密闭容器中的反应:
3 SiCl4(g)+2H2(g)+Si(s) 4SiHCl3(g)
4SiHCl3(g)
达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于离子交换膜法的电解产物,理论上需消耗纯NaCl的质量为?? ______kg。
(3)采用无膜电解槽电解饱和食盐水,可制取氯酸钠,同时生成氢气,现制得氯酸钠213.0kg,则生成氢气?????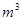 (标准状况)。
(标准状况)。
参考答案:(1)阳极产生的气体是氯气;NaOH溶液的出口为a(填字母)
本题解析:
分析:(1)电解饱和食盐时阳极阴离子Cl-、OH-放电,Cl-的放电能力强于OH-,阳极发生的方程式为:2Cl--2e-═Cl2↑,阴极:2H++2e-═H2↑;H2、2NaOH在阴极,NaOH溶液的出口为a,Cl2在阳极,精制饱和食盐水从阳极进入,要干燥Cl2需要用酸性干燥剂或中性干燥剂.
(2)①SiCl4与H2和O2反应,产物有两种,光导纤维的主要成分是SiO2,H、Cl元素必在另一产物中,H、Cl元素结合成HCl,然后配平即可;
②利用三段分析法,根据平衡时H2与SiHCl3物
本题难度:一般
2、选择题 如图为用惰性电极电解CuCl2溶液并验证其产物的实验装置,则下列说法不正确的是(???? )

A.电源a极为负极
B.KI—淀粉溶液会变蓝色
C.若加入适量CuCl2可使电解后的溶液恢复原状态
D.电极Ⅰ上发生的电极反应为:Cu-2e-=Cu2+
参考答案:D
本题解析:
试题分析:电极Ⅱ为电解池的阳极,溶液中的氯离子放电,生成氯气,通入KI—淀粉溶液中,溶液变蓝色,与Ⅱ相连的是电源的正极b,则a为电源的负极,CuCl2溶液电解时消耗的是溶质CuCl2,所以加入适量CuCl2可使电解后的溶液恢复原状态,电极Ⅰ上发生的电极反应为:Cu2+ + 2e- = Cu。故D不正确。
本题难度:简单
3、填空题 用铂电极电解氢氧化钠溶液,测定两极逸出气体的体积,记录如下
时间/min气体体积/L
| 1
| 2
| 3
| 4
| 5
| 6
| 7
| 8
|
阴极生成的气体
| 6
| 12
| 20
| 29
| 39
| 49
| 59
| 69
|
阳极生成的气体
| 2
| 4
| 7
| 11
| 17
| 23
| 28
| 34
(1)完成有关的电极反应式:阴极__________;阳极____________;
(2)完成电解的总化学方程式_______________________________;
(3)开始电解阶段两极产生气体的体积比不符合理论比值的原因是______________________;
(4)自第__________分钟起阴极与阳极产生气体的体积比约为理论的比值;
(5)该过程NaOH溶液的pH如何变化__________________________________。
参考答案:(1)4H++4e-====2H2↑? 4OH--4e-==
本题解析:电解NaOH溶液相当于电解水,但随着水量的减少,NaOH浓度逐渐增大。
本题难度:简单
4、选择题 下列叙述与对应图式正确的是
| ①
| ②
| ③
| ④
| ⑤
| ⑥
| ⑦
| ⑧
| 原子半径
| 0.74
| 1.60
| 1.52
| 1.10
| 0.99
| 1.86
| 0.75
| 0.82
| 主要化合价
| -2
| +2
| +1
| +5、-3
| +7、-1
| +1
| +5、-3
| +3
A.由下列短周期元素性质的数据推断元素③最高价氧化物对应的水化物碱性最强
B.图甲装置中,待镀铁制品应与电源负极相连
C.图乙表示H2与O2发生反应过程中的能量变化,则H2的燃烧热的热化学方程式为:2H2(g)+O2(g)=2H2O(g) △H=" —" 483.6 kJ/mol
D.图丙表示某一放热反应,若使用催化剂E1、E2、△H都会发生改变
参考答案:B
本题解析:
试题分析:根据表格提供的数据可知:①是O;②是Mg;③是Li;④是P;⑤是F;⑥是Na;⑦是N;⑧是Al。A.由于在上述元素中金属性最强的是Na,所以由下列短周期元素性质的数据推断元素⑥最高价氧化物对应的水化物碱性最强,错误;B.在图甲电镀装置中,待镀铁制品应与电源负极相连,镀层金属与电源的正极连接,作阳极,正确;C.图乙表示H2与O2发生反应过程中的能量变化,由于燃烧热是1mol的可燃物完全燃烧产生稳定的氧化物时所放出的热量,H2O的稳定的氧化性是液态水,则H2的燃烧热的热化学方程式中的△H<— 241.8 kJ/mol ,错误;D.图丙表示某一放热反应,若使用催化剂E1、E2都会发生改变,但是△H不变,错误。
考点:考查元素的性质与原子结构的关系、电镀、热化学方程式的书写及反应热与焓变和活化能的关系的知识。
本题难度:一般
5、填空题 甲、乙两池电极材料都是铁棒与碳棒(如下图)。请回答下列问题:
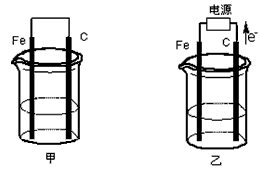
(1)若两池中均盛放CuSO4溶液,反应一段时间后:
①有红色物质析出的是:甲池中的___________ 棒;乙池中的____________ 棒。
②在乙池中阳极的电极反应式是_____________ 。
(2)若两池中均盛放饱和NaCl溶液。
①写出甲池中正极的电极反应式____________________ 。
②将湿润的淀粉KI试纸放在乙池附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的
Cl2将生成的I2氧化。若反应的Cl2和I2的物质的量之比为5∶1,且生成两种酸。该反应的化学方程式为___________________ 。
③若乙池转移0.02mol电子后停止实验,池中溶液的体积是200mL,则此时溶液的pH= ______________。(不考虑电解产物的相互反应)
参考答案:(1)① 碳(C );铁(Fe)
② 4 OH--4
本题解析:
本题难度:一般
|
|