微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 三氟化氮(NF3)是微电子工业中一种优良的等离子蚀刻气体,无色、无臭,在潮湿空气中泄露会产生白雾、红棕色气体等现象,反应方程式为:aNF3+bH2O=c____+dHNO3+eHF。下列说法正确的是[???? ]
A.反应方程式横线处物质为NO,且a=3、b =5、c=2、d=1、e=9
B.反应中被氧化与被还原的原子物质的量之比为2:1
C.若反应中生成0.2 mol HNO3,则反应共转移0.2 mol e-
D.反应中NF3是氧化剂,H2O是还原剂
参考答案:A
本题解析:
本题难度:一般
2、选择题 2008年北京奥运会主体育场——“鸟巢”,被《泰晤士报》评为全球 “最强悍”工程。 “鸟巢”运用了高强度、高性能的钒氮合金高新钢和884块ETFE膜,并采用新一代的氮化镓铟高亮度LED材料。有关说法正确的是

A.合金的熔点通常比组分金属高,硬度比组分金属小
B.已知Ga处于ⅢA主族,可推知氮化镓化学式为Ga3N2
C.用金属铝与V2O5冶炼钒,铝作还原剂
D.ETFE膜( )是由两种单体缩聚而成的
)是由两种单体缩聚而成的
参考答案:C
本题解析:合金的熔点通常比组分金属低,硬度比组分金属大,A错误;氮化镓化学式为GaN;由ETFE膜的结构可以看出它是由两种单体加聚而成。
本题难度:一般
3、填空题 (15分)硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
⑴SO2和O2反应制取SO3的反应原理为:2SO2+O2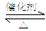 2SO3,在一密闭容器中一定时间内达到平衡.
2SO3,在一密闭容器中一定时间内达到平衡.
①该反应的平衡常数表达式为:??????????????????.
②该反应达到平衡状态的标志是???????.
A.v(SO2)=v(SO3)??????? B.混合物的平均相对分子质量不变
C.混合气体质量不变??? D.各组分的体积分数不变
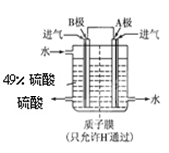
⑵某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图,电极为多孔的材料能吸附气体,同时也能使气体与电解质溶液充分接触.
 ?
?
①B电极的电极反应式为??????????????;
②溶液中H+的移动方向由?????极到?????极;(用A、B表示)
⑶测定绿矾产品中含量的实验步骤:
a.称取5.7 g产品,溶解,配成250 mL溶液
b.量取25 mL待测液于锥形瓶中
c.用硫酸酸化的0.01 mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积40 mL
根据上述步骤回答下列问题:
①滴定时发生反应的离子方程式为(完成并配平离子反应方程式).
??Fe2++??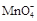 + ???????????——??Fe3++??Mn2++??????????
+ ???????????——??Fe3++??Mn2++??????????
②用硫酸酸化的KMnO4滴定终点的标志是???????????????.
③计算上述产品中FeSO4·7H2O的质量分数为???????????.
参考答案:⑴① 本题解析:
本题解析:
试题分析:(1)①根据平衡常数的概念可知 。
。
②A项没有正逆反应速率,不能判断;B项混合物的平均相对分子质量反应前后不同,可以判断;C项混合气体的质量反应前后不变,不能判断;D项各组分的体积分数反应前后不同,可以判断。答案选BD。
(2)①根据B极的产物可以看出B极发生氧化反应,是负极,电极方
本题难度:困难
4、选择题 过氧化氢(O为—1价)在二氧化锰催化作用下分解放出氧气的反应机理如下:
①MnO2 + H2O2 + 2H+ = Mn2+ + O2↑ + 2H2O???②Mn2+ + H2O2 = MnO2 + 2H+
下列说法正确的是(????)
A.H2O2在①中是氧化剂,在②中是还原剂
B.在①中每生成1 mol O2,转移的电子数为1.204×1024
C.Mn2+在①中是还原产物,在②中是氧化产物
D.在二氧化锰催化作用下,1 mol H2O2分解生成22.4 L O2
参考答案:B
本题解析:
试题分析:A.H2O2在①中是还原剂,在②中是氧化剂,所以A错误;C.Mn2+在①中是还原产物,在②中是氧化剂;所以C错误。D.在二氧化锰催化作用下,1 mol H2O2分解生成0.5 mol O2. D错误.
本题难度:一般
5、选择题 实验室制取少量N2,常利用的反应是:NaNO2+NH4Cl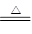 NaCl+N2↑+2H2O,关于该反应的说法正确的是
NaCl+N2↑+2H2O,关于该反应的说法正确的是
A.NaNO2是氧化剂,发生还原反应
B.生成1mol N2时转移的电子数为6mol
C.NH4Cl中的N元素被还原
D.N2既是氧化剂又是还原剂
参考答案:A
本题解析:
试题分析:A、正确;B、生成1mol N2时转移的电子数为3mol,错误;C、NH4Cl中的N元素被氧化,错误;D、N2既是氧化产物又是还原产物,错误。
本题难度:一般