微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
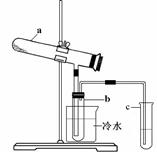
1、实验题 (16分)如右图所示,B中盛装的是一种固体物质。当A中的溶液滴入B内反应一段时间后,所得产物经装置C后可得到纯净的气体X,每个X分子中含有10个电子。D中盛装的是黑色粉末,当X气体通过D时,黑色粉末逐渐变成红色,最后从E装置中出来的气体是一种纯净的单质Y,Y在标准状况下的密度为1.25g/L。装置中A、B、C、D、E中的药品只能从下列所给试剂a~p中选择,图中某些夹持仪器未画出。
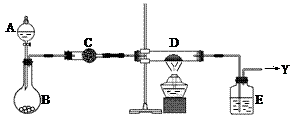
a.浓硫酸 b.浓硝酸 c.稀硝酸 d.浓盐酸 e.稀硫酸 f.浓氨水
g.铜片 h.锌片 i.碱石灰 j.硫酸铜 k.生石灰 l.硝酸铵晶体
m.固体烧碱 n.稀NaOH溶液 o.CuO p.MnO2
回答下列问题:
⑴C装置内的药品是?????(用a~p中的字母表示),其作用是??????????。
⑵A中溶液和B中固体的所有可能的组合共有???????种。
⑶纯净气体X通过D时,发生反应的化学方程式是??????????????,反应中若转移电子的物质的量为1.2mol,则D装置中黑色固体共失重????????g。
⑷E中的药品是?????????(用a~p中的字母表示),其作用是?????????????。
参考答案:⑴i(或k,或m,2分);干燥氨气(2分)
⑵3(3分
本题解析:(1)由题意“单质Y在标准状况下的密度为1.25g/L”可知,M(Y)=28,单质Y为N2。又X气体通过D时,黑色粉末逐渐变成红色,且生成N2,X分子中含有10个电子,那么X为氨气。黑色粉末为CuO。(2)A中溶液和B中固体的所有可能的组合为:浓氨水与生石灰,浓氨水与固体烧碱,硝酸铵晶体与稀NaOH溶液。,共3组。(3)转移电子的物质的量为1.8mol时,参与反应的CuO的物质的量为0.9mol,CuO共失重为:0.9×16=14.4g。⑷E中的药品是用来吸收氨气和水蒸汽,要用浓硫酸。
本题难度:一般
2、填空题 三氯化铁熔点282 ℃、沸点315 ℃,能吸收空气里的水分而潮解。它可广泛用于污水处理、电子工业、印染业、建筑业,某化学实验小组的同学欲用下列仪器制备FeCl3固体。

(1)写出制备氯气时的离子方程式_______________________
(2)所选用的仪器连接顺序(填写接口字母)为___________n→d__________
(3)实验过程中,给A、B仪器加热的顺序为_____________________,这样操作的目的是_______________,可作为点燃B处酒精灯的实验标志是_________________;若C可以用D代替,则使用C的目的是______________________。若缺少此类装置,此B中可能发生的另一个反应的方程式为________________________。
(4)有同学认为,若不使用E装置,则B中会有FeCl2生成,请设计一个实验确定此观点是否正确________________________________________________________________。
参考答案:(1) MnO2+4H++2Cl-=Mn2++Cl2↑+2H
本题解析:
试题分析:(1)实验室利用二氧化锰和浓盐酸在加热条件下反应生成二氯化锰、氯气和水,离子方程式为MnO2+4H++2Cl-=Mn2++Cl2↑+2H2O;(2)根据题给信息知,三氯化铁能吸收空气里的水分而潮解,所以准备过程中要防止水蒸气的干扰;制备的氯气中含有HCl、H2O(g),需要用饱和食盐水除去HCl、用浓硫酸除去H2O,氯气有毒,多余的气体必须进行尾气处理。所选用的仪器连接顺序(填写接口字母)为a→h→i→f→g→b→c→m→ n→d→e→j;(3)因铁能与装置内氧气反应,故要先制备氯气并利用它排除装置内空气,防止铁被空气氧化,所以实验过程中,给A、B仪器加热的顺序为先点燃A处酒精灯;这样操作的目的是用生成的Cl2排除装置内空气,防止铁被氧气氧化;可作为点燃B处酒精灯的实验标志是B中充满黄绿色气体;若C可以用D代替,则使用C的目的是防止水蒸气进入B中导致FeCl3水解;若缺少此类装置,此B中可能发生的另一个反应的方程式为2FeCl3+3H2O  Fe2O3+6HCl。(4)若不除去HCl,HCl可能与铁反应生成FeCl2,检验有无FeCl2生成的就是检验产物中有无Fe2+,实验方案为:取样品少量制成溶液,向溶液中加入K3[Fe(CN)6]溶液,若有蓝色沉淀生成,此观点正确,否则不正确。
Fe2O3+6HCl。(4)若不除去HCl,HCl可能与铁反应生成FeCl2,检验有无FeCl2生成的就是检验产物中有无Fe2+,实验方案为:取样品少量制成溶液,向溶液中加入K3[Fe(CN)6]溶液,若有蓝色沉淀生成,此观点正确,否则不正确。
本题难度:一般
3、实验题 纳米碳酸钙广泛应用于橡胶、塑料、造纸、化学建材、油墨、涂料、密封胶与胶粘剂等行业。在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙。某校学生实验小组设计下图所示装置,制取该产品。D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去。
Ⅰ.可选用的药品有:
a.石灰石;b.饱和氯化钙溶液;c.6 mol/L盐酸;d.氯化铵;e.氢氧化钙
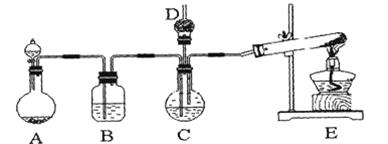
(1)A中制备气体时,所需药品是(选填字母序号)??????????????;
(2)B中盛有饱和碳酸氢钠溶液,其作用是??????????????????????????????;
(3)写出制取氨气的化学方程式??????????????????????????????????;
(4)在实验过程中,向C中通入气体是有先后顺序的,应先通入气体的化学式?;
(5)检验D出口处是否有氨气逸出的方法是??????????????????????????;
(6)写出制纳米级碳酸钙的化学方程式??????????????????????????????。
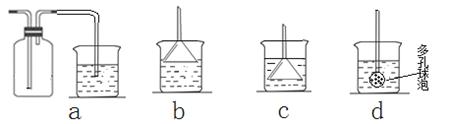
(7)若实验过程中有氨气逸出,应选用下列?????????????装置回收(填代号)。
Ⅱ.经分析在上述氯化铵样品中含有杂质碳酸氢钠。为了测定氯化铵的质量分数,该学生实验小组又设计了如下实验流程:
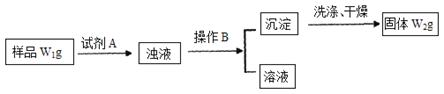
试回答:
(1)所加试剂A的化学式为??????????????????????????????????????
(2)B操作方法是???????????????????????????????????????????????
(3)样品中氯化铵的质量分数为???????????????????????????????????。
参考答案:Ⅰ.(1)ac(1分)(2)除去CO2中的HCl(1分)??
本题解析:
试题分析:Ⅰ.(1)分析题意知,装置A为碳酸钙与盐酸反应制二氧化碳,所需药品是石灰石和6mol/L盐酸,答案为:ac;(2)饱和NaHCO3溶液可除去二氧化碳中的氯化氢;(3)实验室制取氨气采用氯化铵和氢氧化钙加热,生成氯化钙、氨气和水,方程式为:2NH4Cl + Ca(OH)2 CaCl2 + 2NH3↑+ 2H2O;(4)氨气极易溶于水,先通入氨气利于二氧化碳的吸收,所以应先通入NH3;(5)氨气是碱性气体,能使红色石蕊试纸变蓝;氨气能和浓盐酸反应生成白烟,答案为:将湿润的红色石蕊试纸放在D出口处,若试纸变蓝,则证明有氨气逸出;若试纸不变蓝,则证明没有氨气逸出。(或用蘸有浓盐酸的玻璃棒靠近D出口处,若有白烟,则证明有氨气逸出;若没有白烟,则证明没有氨气逸出。);(6)制纳米级碳酸钙的化学方程式为:CaCl2+CO2+2NH3+H2O=CaCO3+2NH4Cl;(7)氨气极易溶于水要防止倒吸,答案为:b;
CaCl2 + 2NH3↑+ 2H2O;(4)氨气极易溶于水,先通入氨气利于二氧化碳的吸收,所以应先通入NH3;(5)氨气是碱性气体,能使红色石蕊试纸变蓝;氨气能和浓盐酸反应生成白烟,答案为:将湿润的红色石蕊试纸放在D出口处,若试纸变蓝,则证明有氨气逸出;若试纸不变蓝,则证明没有氨气逸出。(或用蘸有浓盐酸的玻璃棒靠近D出口处,若有白烟,则证明有氨气逸出;若没有白烟,则证明没有氨气逸出。);(6)制纳米级碳酸钙的化学方程式为:CaCl2+CO2+2NH3+H2O=CaCO3+2NH4Cl;(7)氨气极易溶于水要防止倒吸,答案为:b;
Ⅱ.(1)根据题目信息可知:碳酸氢钠能与氢氧化钡或氢氧化钙反应生成碳酸钡或碳酸钙沉淀,根据沉淀的质量求出碳酸氢钠的质量,最后求出氯化铵的质量以及质量分数;氯化铵能与硝酸酸化的硝酸银反应生成氯化银沉淀,根据沉淀的质量求出氯化铵的质量,最后求出氯化铵的质量分数;所以A为Ca(OH)2或Ba(OH)2或AgNO3和HNO3;(2)操作B为不溶物和溶液分离操作,用过滤的方法;(3)若试剂为Ca(OH)2溶液,根据碳守恒得关系式:NaHCO3——CaCO3,计算得NaHCO3的质量为84W2/100g,则氯化铵的质量为(W1—84W2/100)g,氯化铵的质量分数为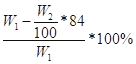 ,若试剂为Ba(OH)2溶液,同理可计算氯化铵的质量分数为
,若试剂为Ba(OH)2溶液,同理可计算氯化铵的质量分数为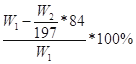 ,若试剂为AgNO3和HNO3,由关系式NH4Cl——AgCl计算得氯化铵的质量分数为53.5W2/143.5W1×100%。
,若试剂为AgNO3和HNO3,由关系式NH4Cl——AgCl计算得氯化铵的质量分数为53.5W2/143.5W1×100%。
本题难度:一般
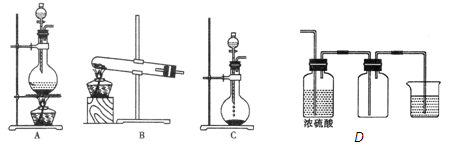
4、实验题 (12分)实验室常用的几种气体发生装置如图A、B、C所示:
 ????
????
(1)实验室可以用B或C装置制取氨气,如果用C装置,通常使用的药品是????????。检查C装置气密性是否良好的操作方法是?????????。
(2)气体的性质是气体收集方法选择的主要依据。下列性质与收集方法无关的是??????(填序号,下同。)
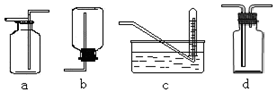
①密度??②颜色??③溶解性??④热稳定性??⑤与氧气反应
下图是某学生设计收集气体的几种装置,其中不可行的是??????
(3)若用A装置与D装置相连制取收集X气体,则X可能是下列气体中的_______
①CO2????② NO????③ Cl2????④H2
其中在D装置中连接小烧杯的目的是________________________。
参考答案:(1)浓氨水和氧化钙(或碱石灰、固体氢氧化钠等);将导气管通
本题解析:(1)C装置不需要加热,所以要制取氨气,所用试剂是浓氨水和氧化钙(或碱石灰、固体氢氧化钠等)。关闭分液漏斗的活塞,将导气管通入水槽中,用手捂或热毛巾捂圆底烧瓶,看导气管处有气泡产生,松开手或热毛巾后,导气管处形成一段稳定的液柱,则说明气密性良好。
(2)收集气体一般要考虑气体的密度、溶解性和能否与氧气反应等,所以答案选②④。根据装置图可知,b中空气排不出来,c中导管口应该放在试管口处,所以bc是不可以的,ad可以,答案选bc。
(3)根据装置可知,反应需要加热,因此①不正确。NO极易被氧化,不能用排气法收集,②不正确。根据D可知,气体的密度大于空气的,所以答案选③。氯气有毒,需要尾气处理,以防止污染空气。
本题难度:一般
5、实验题 (10分)工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即在沸腾炉中煅烧黄铁矿、SO2的催化氧化及其SO3的吸收。请回答下列几个有关硫酸工业中的几个问题。
(1)生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧。反应的化学方程式为:2FeSO4·7H2O  ?Fe2O3 + SO2↑+ SO3↑+ 14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。下列关于该反应说法正确的是(???? )
?Fe2O3 + SO2↑+ SO3↑+ 14H2O。其中三氧化硫与水蒸气同时冷凝便得到硫酸。用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去)。其中b为干燥的试管。下列关于该反应说法正确的是(???? )
A.若将反应后的三种气体通入BaCl2溶液中,产生的沉淀为BaSO3、BaSO4
B.b中产物用紫色石蕊试液即可检验出其中H+和SO42—
C.为检验反应的另一种生成物,试管c中应加入的试剂为NaOH溶液
D.b中所得到的硫酸的质量分数为29.5%
(2)从沸腾炉中出来的炉气必须经除尘、洗涤、干燥后进入接触室,其主要目的是__________。
(3)接触室中热交换器是实现冷热交换的装置。化学实验中也经常利用热交换来实现某种实验目的,如气、液热交换时通常使用的仪器是______________。
(4)接触室中主要反应是SO2的催化氧化,在生成硫酸的过程中,钒触媒(V2O5)所以能加快二氧化硫氧化的速度,除了具有吸附作用外,有人认为反应过程中还产生了一连串的中间体(如图)。c步的化学方程式可表示为_______________________。

(5) 工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中的SO2转化为有用的副产品。将尾气通入粉末状的碳酸钙或熟石灰的悬浊液中,经过一系列处理后得到一种相对分子质量为172的化工原料J。试写出J的化学式_________。
参考答案:(1) D(2分),(2)防止催化剂中毒(2分)??????
本题解析:(1)将分解生成的气体通入BaCl2溶液中,生成的沉淀是BaSO4;根据绿矾分解的方程式,产物Fe2O3留在试管中,SO3和H2O同时冷凝便得到硫酸,收集在试管a中,硫酸的检验分为两部分,既要检验H+,又要检验SO42—,要回答全面。试管b中溶液用来检验SO2气体,故用品红溶液,SO2能使品红溶液退色,加热红色恢复。根据生成SO3与水的物质的量之比,可以求得生成硫酸的理论浓度:设生成1molSO3和14molH2O,硫酸的质量分数为98/(80+14×18)=29.5%。(2)由于接触室中使用V2O5作催化剂,为防止催化剂中毒,因此必须进行除杂操作。(4)根据催化剂的性质可知催化剂(V2O5)在反应过程中先参与反应,而后又生成,化学性质和质量在反应前后不变,在反应a中钒元素化合价降低被还原,可推知还原剂应为SO2,化学方程式可表示为SO2+V2O5=V2O4+SO3,反应b中根据元素守恒可确定SO2也参与反应,钒元素化合价不变,硫元素化合价升高被氧化,因此反应过程中O2也参与反应,化学方程式可表示为V2O4+2SO2+O2=2VOSO4,该反应属于化合反应,因此原子利用率为100%,反应c中有V2O5生成,可推知反应c为2VOSO4=SO2+V2O5+SO3。
(5)要考虑到SO2和碱或盐反应生成的亚硫酸盐,亚硫酸盐有较强的还原性易被空气氧化,结合产物的相对分子质量172可确定产物为生石膏CaSO4·2H2O,其中反应的化学方程式可表示为:2SO2+O2+2CaCO3+4H2O=2 [CaSO4·2H2O] +2CO2或2SO2+O2+2Ca(OH)2+2H2O=2 [CaSO4·2H2O]
本题难度:一般