49.7
?
下列说法正确的是(?? )
A.应选用CaCl2·6H2O
B.可选用Na2SO4·10H2O和Na2HPO4·12H2O
C.最好选用Na2SO4·10H2O,它更经济
D.以上皆不宜选用
参考答案:C
本题解析:由表中所给数据分析:Na2HPO4·12H2O和Na2S2O3·5H2O的熔点高于天气温度,不适合。CaCl2·6H2O和Na2SO4·10H2O比较,后者吸热效果好。
本题难度:一般
2、填空题 (16分)氯气在298 K、100 kPa时,在1 L水中可溶解0.09 mol,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
(1)该反应的化学方程式为________________________________________________;
(2)估算该反应的平衡常数________________________________(列式计算);
(3)在上述平衡体系中加入少量NaCl固体,平衡将向________移动;
(4)如果增大氯气的压强,氯气在水中的溶解度将_______(填“增大”、“减小”或“不变”),平衡将向________移动。
(5)已知:H2CO3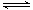 HCO3-+ H+ Ka1(H2CO3) = 4.45×10-7 HCO3-+ H+ Ka1(H2CO3) = 4.45×10-7
HCO3-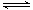 CO32-+ H+ Ka2(H2CO3) = 5.61×10-11 CO32-+ H+ Ka2(H2CO3) = 5.61×10-11
HClO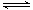 H++ ClO- Ka(HClO) = 2.95×10-8 H++ ClO- Ka(HClO) = 2.95×10-8
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
将少量的氯气通入到过量的碳酸钠溶液中____________________________________;
(6)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。则下列选项中正确的是 。
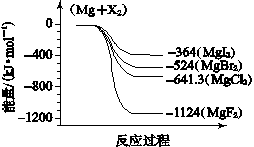
A.MgI2中Mg2+与I-间的作用力小于MgF2中Mg2+与F-间的作用力
B.Mg与X2的反应是放热反应
C.化合物的热稳定性顺序为MgI2>MgBr2>MgCl2>MgF2
D.MgF2(s)+Br2(l)===MgBr2(s)+F2(g) ΔH=+600 kJ·mol- 1
依上图数据写出 MgBr2(s)与 Cl2(g)反应的热化学方程式 。
参考答案:(1)Cl2+H2O 本题解析: 本题解析:
试题分析:(1)氯气与水反应生成盐酸和次氯酸,反应的离子方程式为:Cl2+H2O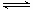 H++Cl-+HClO; H++Cl-+HClO;
(2)在1L水中可溶解0.09mol氯气,近似氯气浓度为0.09mol/L,则
Cl2+H2O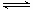 HCl+HClO HCl+HClO
起始浓度:0.09 0 0
转化浓度:0.03 0.03 0.03
平衡浓度:0.06 0.03 0.03
则K=(0.03×0.03)÷0.06=0.015mol/L;
(3)在上述平衡体系中加入少量NaCl固体,增大溶液中的氯离子离子,平衡向逆反应方向进行;
(4)在上述平衡中加压,平衡向气体体积减小的反应方向进行,即平衡向正反应方向移动,氯气的溶解量会增加;
(5)根据电离平衡常数可知碳酸的酸性强于次氯酸,但次氯酸的酸性强于碳酸氢根离子的,则将少量的氯气通入到过量的碳酸钠溶液中生成氯化钠、次氯酸钠和碳酸氢钠,离子方程式为Cl2+2CO32-+H2O=Cl-+ClO-+2HCO3-。
(6)A、相同类型的离子晶体中,离子键越大,则离子间作用力越强,物质含有的能量越低,所以MgI2中Mg2+与I-间的作用力小于MgF2中Mg2+与F-间的作用力,故正确;B、根据图象知,反应物的能量大于生成物能量,所以Mg与F2的反应是放热反应,故正确;C、能量越小的物质越稳定,所以化合物的热稳定性顺序为MgI2<MgBr2<MgCl2<MgF2,故错误;D、⑤Mg(s)+F2(l)=MgF2(s)△H-1124kJ/mol,Mg(s)+Br2(l)MgBr2(s)△H-524kJ/mol,将第二个方程式与第一方程式相减得MgF2(s)+Br2(L)MgBr2(s)+F2(g);△H+600kJ?mol-1,故正确;答案为ABD。Mg(s)+Cl2(l)=MgCl2(s)△H=-641kJ/mol,Mg(s)+Br2(l)=MgBr2(s)△H=-524kJ/mol,将第一个方程式减去第二方程式得MgBr2(s)+Cl2(g)=MgCl2(s)+Br2(l)△H=-117KJ?mol-1。
考点:考查平衡常数计算与应用、外界条件对平衡状态的影响;物质结构与性质以及盖斯定律的应用等
本题难度:困难
3、填空题 (4分)已知1mol H2燃烧生成液态水放出热量为285.8kJ,C2H4、C2H6各1mol分别燃烧生成液态水和CO2,放出热量分别为1409.5kJ、1558kJ。试写出C2H4生成C2H6的热化学方程式 。

参考答案:C2H4(g)+H2(g)=C2H6(g) △H=
本题解析:
试题分析:根据已知信息可知,氢气、乙烯和乙烷燃烧的热化学方程式分别是①H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8kJ/mol;②C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) ΔH=-1409.5kJ/mol;③C2H6(g)+7/2O2(g)=2CO2(g)+3H2O(l) ΔH=-1558kJ/mol。所以根据盖斯定律可知,①+②-③即得到C2H4(g)+H2(g)=C2H6(g),所以该反应的反应热△H=-285.8kJ/mol-1409.5kJ/mol+1558kJ/mol=-137.3kJ/mol。
考点:考查盖斯定律的应用和反应热的计算
点评:该题是高考中的常见考点,属于中等难度的试题。试题基础性强,侧重对学生基础知识的巩固与训练,有助于培养学生的逻辑推理能力和应试能力,提高学生的学习效率。该题的关键是准确写出有关反应的热化学方程式,然后根据盖斯定律直接列式计算即可。
本题难度:一般
4、填空题 (5分)用相关的化学用语表示下列物质:
⑴ 写出电子式Al3+?????????????Cl ???????????????
⑵ 写出下列物质的结构式:N2 ???????????????????CO2???????????????????
⑶ 用电子式表示NaOH_______________________
参考答案:略
本题解析:
试题分析:(1)电子式是在元素符号周围用×或点表示元素原子的最外层电子,故阳离子Al3+本身就是它的电子式,氯原子最外层有7个电子,在Cl元素符号周围写上7个电子即为电子式;(2)氮气分子中存在氮氮三键,故结构式为:N≡N;二氧化碳中碳和氧之间是碳氧双键,故结构式为:O=C=0;(3)离子化合物的电子式表示出阳离子和阴离子,钠离子的电子式就是钠离子本身,写上氢氧根离子的电子式即得氢氧化钠的电子式。
本题难度:一般
5、填空题 (1)分析下列物体的物理性质,判断其晶体类型:
①碳化铝为黄色晶体,熔点为2200℃熔融态不导电。___________;
②五氟化钒为无色晶体,熔点为19.5℃,易溶于乙醇、氯仿、丙酮中。____________;
③溴化钾为无色晶体,熔融时或溶于水中都能导电。___________;
(2)从能量角度看,断开化学键要_________,形成化学键要___________。
(3)水的分解需要吸收热量,试从化学键变化的角度分析原因_________________________________,该反应△H________0(填<,>)。
参考答案:(1)①原子晶体;②分子晶体;③离子晶体
(2)吸收能
本题解析:
本题难度:一般
|