微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 浓氨水可与新制生石灰作用生成氨气,干燥的氨气在高温下能被CuO氧化成N2实验室欲用图仪器装置和药品来制取纯净的氮气。
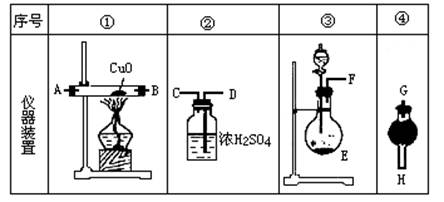
试回答下列问题:
(1)这些装置按气流方向自左向右的连接顺序是(填A、B、C……)____????____。
(2)E中发生反应的化学方程式是____??????????????????????????____。
(3)装置④中应当选用的干燥剂是(写名称)____???????_______。
(4)装置①中发生氧化还原反应的化学方程式是___?????????????????________。其中氧化剂是____??__,氧化产物是______??__(写化学式)。
(5)装置②中浓硫酸的作用是_____?????????????????????____。
参考答案:(1)F→G→H→A→B→D→C(A、B顺序可颠倒);(2)
本题解析:本题综合考查运用氧化还原反应等知识,以及气体制取、干燥、尾气吸收等实验技能,解决新情境下化学实际问题的能力。本题中生成氨气和氨氧化反应的原理及产物,不难根据题给的条件确定,不再赘述。在此基础上,可依题目叙述的顺序,将各步的条件、任务与备选装置结合起来,找出相应的仪器装置,再合理连接起来,以完成整体实验装置的选择与组装。浓氨水与新制生石灰作用生成氨气,属于固体与溶液反应制气体,应选用装置③;“干燥的氨气”暗示接下来应该是干燥气体的装置。鉴于浓硫酸吸收氨气生成硫酸铵,不是干燥氨气,而是吸收氨气的装置,此干燥装
本题难度:简单
2、填空题 不同金属离子在溶液中完全沉淀时,溶液的pH不同。
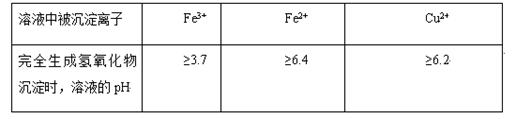
氯化铜晶体(CuCl2·2H2O)中含FeCl2杂质,为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示的操作步骤进行提纯。
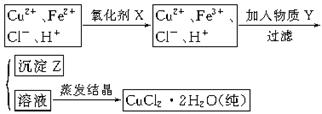
(1)下列氧化剂中适合作氧化剂X的是??????????????(填序号);
A.NaClO
B.H2O2
C.KMnO4
D.Cl2
(2)物质Y的化学式是??????????、????????????;(任写两种)
(3)写出从(2)题任选一个物质Y参与反应生成沉淀Z离子方程式:??????????????。
(4)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体????(填“能”或“不能”)。若能,不用回答;若不能,回答该如何操作??????????????????????。
(5)氢氧化铜常温下其Ksp=c(Cu2+)· c2(OH-)=2×10-20mol2·L-2。某硫酸铜溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH使之大于?????。
参考答案:(1)B、D;(2)CuO或Cu(OH)2或CuCO3;(3
本题解析:
试题分析:(1)在氯化铜晶体(CuCl2·2H2O)中含FeCl2杂质,为制得纯净氯化铜晶体应该把杂质除去。但是Fe2+形成沉淀的pH与Cu2+形成沉淀的pH很相近,不容易除去。若加入氧化剂把Fe2+氧化为Fe3+就很容易除去了。在选择氧化剂时不要引入新的杂质离子。所以应该选择绿色氧化剂B.H2O2或D.Cl2.(2)加入物质Y用以调节溶液的pH值,而且不引入杂质。可以加入CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3等。(3)假设以CuO为例,反应的两种方程式为2Fe3++6H2O+
本题难度:一般
3、填空题 (12分)铁单质及其化合物在生活、生产中应用广泛。请回答下列问题:
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应式为 ______________________。
______________________。
(2)由于氧化性Fe3+>Cu2+,氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是________。
(3)硫酸铁可作絮凝剂,常用于净水,其原理是______________________(用离子方程式表示)。在使用时发现硫酸铁不能使酸性废水中的悬浮物沉降而除去,其原因是__________。
(4)磁铁矿是工业上冶炼铁的原 料之一,其原理是Fe3O4+4CO3Fe+4CO2,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是__________________。
料之一,其原理是Fe3O4+4CO3Fe+4CO2,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是__________________。
(5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是________(填字母)。
选项
| 陈述Ⅰ
| 陈述Ⅱ
| 判断
|
A
| 铁是地壳中含量最高的
金属元素
| 铁是人类最早使用的金属材料
| Ⅰ对;Ⅱ对;有
|
B
| 常温下铁与稀硫酸反应
生成氢气
| 高温下氢气能还原氧化
铁得到铁
| Ⅰ对;Ⅱ对;无
|
C
| 铁属于过渡元素
| 铁和铁的某些化合物可用作催化剂
| Ⅰ错;Ⅱ对;无
|
D
| 在空气中铁的表面能形
成致密的氧化膜
| 铁不能与氧气反应
| Ⅰ对;Ⅱ对;有
参考答案:
 本题解析:略 本题解析:略
本题难度:一般
4、实验题 (10分)某氯化铁样品含有FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:
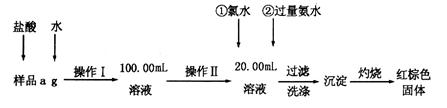
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有________________________(填仪器名称)。
(2)写出加入氯水发生反应的离子方程式____________________。
(3)检验沉淀已经洗涤干净的操作及现象是______________________________________
___________________________________________________________________________。
(4)坩埚质量为W1g,加热后坩埚与红棕色固体总质量为W2g,则样品中铁元素的质量分数是____________________(列出原始算式,不需化简);若称量准确而最终测量的结果偏大,则造成误差的原因可能是_____________________(写出一种原因即可)。
参考答案:
 本题解析: 本题解析:
试题分析:(1)溶液的配制还需要100ml容量瓶和胶体滴管,需要注意的是容量瓶必须注明100ml。
(2)加入氯水后,Cl2把Fe2+氧化为Fe3+。
(3)如果未洗涤干净,沉淀表面含有NH4Cl,所以用AgNO3检验出最后一次洗涤液无Cl?即可。
(4)灼烧后得到的固体为Fe2O3,质量为W2-W1,可算出Fe元素的质量为:112(W2-W1)/160,因为原样品配制了100.00ml溶液,从中取出了20.00ml进行的实验,所以乘以5得原样品中铁元素的质量,进而求出质量分数。
本题难度:一般
5、填空题 CoxFe3-xO4磁粉是一种比较好的高矫顽力磁粉。工业上以FeSO4为原料制备CoxFe3-xO4的主要步骤如下:
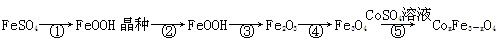
(1)步骤①是在FeSO4溶液中加入NaOH溶液,在40℃下搅拌生成FeOOH晶种。生成晶种的化学方程式为??????;
(2)步骤②将晶种移到放有FeSO4溶液和铁皮的生长槽中,升温到60℃,吹入空气,待晶种长大到一定尺寸后,过滤、水洗、干燥,得FeOOH粉末。生长槽中放入铁皮的目的是??????,吹入空气的作用为????????。
(3)步骤③将FeOOH在200~300℃下加热脱水,生成红色Fe2O3。实验室完成该操作需要下列仪器中的????????(填字母)。
a.蒸发皿 b.烧杯 c.坩埚 d.泥三角 e.酒精灯
(4)步骤④通入H2,加热至300~400℃,生成Fe3O4。通入H2前要向加热炉中通入N2,其作用为????????。
(5)步骤⑤加入CoSO4溶液,所得粗产品经过滤、洗涤、干燥即得成品。检验粗产品洗涤干净的实验操作和现象是????????。
(6)某研究小组欲用锂离子电池正极废料(含LiCoO2、铝箔、铁的氧化物)制备CoSO4·7H2O晶体。下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
金属离子
| 开始沉淀的pH
| 沉淀完全的pH
| Fe3+
| 1.1
| 3.2
| Fe2+
| 5.8
| 8.8
| Co2+
| 6.9
| 9.4
?
请完成下列实验步骤(可选用的试剂:H2O2、稀硝酸、稀硫酸、NaOH溶液):
①用N-甲基吡咯烷酮在120℃下浸洗正极废料,使LiCoO2与铝箔分离,得到LiCoO2粗品并回收铝。
②????????。
③向所得粗品CoSO4溶液中加入NaOH溶液,调节pH约为5,过滤。
④????????。
⑤将Co(OH)2沉淀溶于稀硫酸中,蒸发浓缩、降温结晶,得到CoSO4·7H2O晶体。
参考答案:
(1)4FeSO4+8NaOH+O2![]()
本题解析:
试题分析:(1)该反应的反应物为FeSO4、NaOH和O2,产物为FeOOH;(2)在此条件下反应生成酸,会对导致晶种溶解,铁反应消耗掉生成的硫酸,同时补充原料FeSO4;溶液中铁为+2价,通入氧气为氧化剂,使其被氧化为+3铁;(3)加热固体用坩埚,与其配套的有泥三角、三脚架、坩埚钳、酒精灯等;(4)氢气易燃,在有氧气存在下加热会发生爆炸,故先用氮气排尽空气;(5)取最后一次洗涤滤出液少许于试管中,滴加氯化钡溶液,如果不产生白色沉淀,则表明洗涤干净;(6)第①分离出LiCoO2粗品,第③得CoSO
本题难度:一般
|
|