微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 [2012·潍坊一模] (14分)黄铜矿的主要成分是CuFeS2,是工业炼铜的主要原料。已知黄铜矿在空气中焙烧生成Cu、FeS和SO2,FeS+2HCl=FeCl2+H2S↑,H2S是一种剧毒气体。某科研小组设计以黄铜矿为原料制取单质铜和氯化铁晶体(FeCl3·6H2O)的流程如下:
?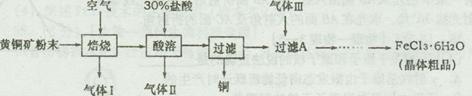
(1)92gCuFeS2在空气中焙烧生成Cu、FeS和SO2转移电子的物质的量为????????。
(2)请简述检验气体Ⅰ的操作步骤????????????????????????????。
(3)在实验室中,欲用38%(密度为1.18g·mL-1)的盐酸配制30%的盐酸,需要的玻璃仪器主要有????????????????????。
(4)气体Ⅲ最好选用?????????(填写序号),其主要作用是????????????????。
A.O2
B.H2
C.Cl2
D.N2
欲选用下列仪器在实验室中制取纯净干燥的该气体。
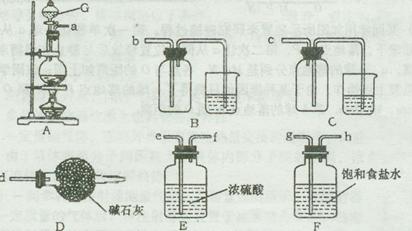
装置A中发生反应的离子方程式为????????????????????。
选用合适装置导管口的连接顺序为a接???????????。图中仪器G的名称是???????;在使用该仪器时,应首先???????。
2、填空题 Fe(OH)2很不稳定,露置在空气中容易被氧化,发生反应的方程式为:?????????????????
为了获得白色的Fe(OH)2沉淀,可以用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用FeSO4晶体配制上述FeSO4溶液时我觉得还需加入?????来防止Fe2+被氧化。
(2)除去蒸馏水中溶解的O2常采用?????的方法。
(3)检验Fe3+的最佳试剂是?????????,简述其检验方法:???????????。
3、简答题 (14分)甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。

(1)B中反应的离子方程式是____。
(2)A中溶液变红的原因是____。
(3)为了探究现象II的原因,甲同学进行如下实验。
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在?????。
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液。
甲同学的实验证明产生现象Ⅱ的原因是SCN—与Cl2发生了反应。
(4)甲同学猜想SCN—可能被Cl2氧化了,他又进行了如下研究。
资料显示:SCN—的电子式为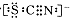
①甲同学认为SCN—中碳元素没有被氧化,理由是?????????。
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN—中被氧化的元素是??????????。
③通过实验证明了SCN—中氮元素转化为NO3-,他的实验方案是____。
④若SCN—与Cl2反应生成1 mol CO2,则转移电子的物质的量是??????mol。
4、选择题 下列说法正确的是[???? ]
A.钠保存在煤油里的原因之一是它极易与氧气反应
B.铝在空气中很容易燃烧
C.镁表面的氧化膜疏松,不能保护内层金属
D.铁锈的主要成分是Fe3O4
5、选择题 某CuO粉末与适量的硫酸(ρ=1.7g·cm-3)在微热下充分反应,冷却后恰好全部形成CuSO4·5H2O(设反应过程中无水份损失)。则此硫酸溶液的物质的量浓度为
A.8.5mol·L-1
B.10.0mol·L-1
C.17.0mol·L-1
D.18.4mol·L-1