微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 有一固体混合物,可能由NaI、KCl、Na2CO3、Na2SO4、CaCl2、Cu(NO3)2中的一种或几种组成,为了检验所含的物质,做了以下实验:
①取少许固体溶于水,得到无色透明溶液;
②往此溶液中滴加氯化钡溶液,有白色沉淀生成;
③过滤,往沉淀中加入足量的稀硝酸,发现沉淀没有全部溶解且有无色无味的气体生成。
④往滤液中加入足量的新制的氯水,再加入少许汽油,振荡,静置,上层液体呈紫红色。
(1)试判断:固体混合物中肯定含有?????????????????????????????????,
一定没有?????????????????????????????????????????,
可能含有?????????????????????????????????????????。
(2)对可能含有的物质,如何进行实验以进一步检验。
??????????????????????????????????????????????????????????????????????。
(3)实验④中发生的化学反应属于??????????????????反应(填反应类型),主要实验操作名称叫???????????????。
参考答案:(1)肯定含有Na2CO3、Na2SO4、NaI, (2分)
本题解析:
试题分析:(1)由①,无Cu(NO3)2,且CaCl2和Na2CO3不能同时有;由②,有Na2CO3,无CaCl2;
由③,“部分溶于”有Na2SO4;由④,上层紫红色,上层是苯(萃取,苯密度小于水,易溶解碘),有KI,因此不能确定KCl;因此有Na2SO4,Na2CO3、 KI;无CuCl2、CaCl2,可能有KCl
(2)检验氯化钾,可以做焰色反应。若透过蓝色钴玻璃有紫色火焰,则含KCl;反之,则没有。
(3)实验④中发生的化学反应Cl2+2I-=I2+2Cl-,发生的是氧化还原反应。加入有机溶剂萃取碘单质。
本题难度:一般
2、填空题 过氧化钙可以用于改善地表水质,处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下:
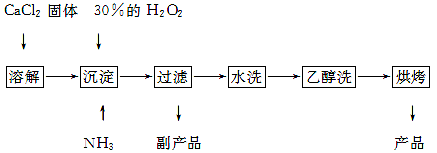
已知CaO2·8H2O呈白色,微溶于水,加热至350 ℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是?????????????????????????????;
(2)检验“水洗”是否合格的方法是????????????????????????????????????????;
(3)沉淀时常用冰水控制温度在0 ℃左右,其可能原因是(写出两种):
①?????????????????????????????????????????????????????????????????;
②??????????????????????????????????????????????????????????????????。
(4)测定产品中CaO2的含量的实验步骤:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
【已知:I2+2S2O32-=2I-+S4O62-】
①CaO2的质量分数为???????????(用字母表示);
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能???????(填“不受影响”、“偏低”或“偏高”),原因是?????????????????????????????????????????????。
参考答案:(1)CaCl2+H2O2+2NH3+8H2O=CaO2·8
本题解析:
试题分析:(1)由流程可知,反应物为氯化钙、双氧水、氨气和水,生成为CaO2·8H2O和氯化铵,反应的化学方程式为:CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4Cl;
(2)验“水洗”是否合格的方法是:取最后一次洗涤液少许于试管中,再滴加稀硝酸酸化的硝酸银溶液,看是否产生白色沉淀;
(3)由于双氧水受热易分解,所以温度低可减少过氧化氢的分解,提高过氧化氢的利用率;另一方面该反应是放热反应,温度低有利于提高CaO2·8H2O产率。
(4)①CaO2具有氧化性,能被碘化钾氧化生成单质碘,方程式为CaO2+2KI+2H2SO4=CaSO4+K2SO4+I2+2H2O。所以根据方程式可知CaO2~2Na2S2O3,因此CaO2的物质的量是0.0005cVmol,所以CaO2的质量分数为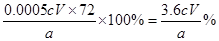 。
。
②如果滴速过慢,而空气中的氧气在酸性条件下也可以把KI氧化为I2,使消耗的Na2S2O3增多,从而使测得的CaO2的质量分数偏高。
本题难度:困难
3、选择题 使相同物质的量浓度的NaCl、MgCl2、AlCl3溶液中的Cl-离子完全沉淀时,若所用相同浓度的AgNO3溶液的体积比为3:2:1,则上述三种溶液的体积比是:
A.9:4:1
B.9:3:1
C.6:3:2
D.3:2:1
参考答案:B
本题解析:试题分析:相同物质的量浓度的NaCl、MgCl2、AlCl3溶液中,Cl-的浓度比为1:2:3,所用相同浓度的AgNO3溶液的体积比为3:2:1,故上述三种溶液的体积比为9:3:1,选B。
考点:化学计量。
点评:化学计量是学习化学的基础,考生应熟练掌握,特别是相关的计算公式的运用。
本题难度:简单
4、选择题 下列实验操作,其中正确的是[???? ]
A.蒸发操作时,应将溶液放入坩埚中加热,直到完全蒸干后停止加热
B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
参考答案:BC
本题解析:
本题难度:简单
5、选择题 有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗x mol H2SO4?、y mol?AgNO3溶液。据此得知原混合液中氯化钠的物质的量浓度(mol/L)为
A.(y-2x)/a
B.(y-x)/a
C.(2y-2x)/a
D.(2y-4x)/a
参考答案:D
本题解析:试题分析:根据题意,反应的有关方程式是Ba2++SO42-=BaSO4↓、Ag++Cl-=AgCl↓。所有溶液中Ba2+的物质的量是x mol、氯离子的物质的量是y mol。则根据溶液的电中性可知,每一份溶液中钠离子的物质的量是(y-2x)mol,所以氯化钠的总的物质的量是2(y-2x)mol,因此氯化钠的浓度是2(y-2x)mol÷a L,答案选D。
考点:考查物质的量浓度的有关计算
点评:该题容易错选A,这是由于忽略了溶液是均分2等份而导致的,所以准确的审清题目要求,也是成功的关键。
本题难度:困难