微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用nA表示阿伏加德罗常数的值。下列叙述正确的是
A.1mol?L-1的Na2CO3溶液中所含钠离子总数为2nA
B.标准状况下,22.4L CH4分子中含质子总数为10nA
C.室温下,28g乙烯和丙烯的混合物中含有的碳原子数为nA
D.常温常压下,33.6L氯气与足量的铝充分反应,转移电子数为3 nA
参考答案:B
本题解析:试题分析:溶液的体积不一定是1L,不能根据物质的量浓度乘以溶液的体积求碳酸钠的物质的量,也不能求钠离子的物质的量,故A选项错误;标准状况下气体摩尔体积为22.4L/mol,可以根据气体体积除以气体摩尔体积求出甲烷的物质的量为1mol,由于1个甲烷分子具有10个质子,则1mol甲烷分子含有10mol质子,故B选项正确;乙烯中碳元素质量分数为6/7,丙烯中碳元素质量分数为6/7,则混合气体中碳元素质量分数为6/7,28g混合气体中含有24g碳原子,根据碳原子的质量除以碳原子的摩尔质量可以求出碳原子的物质的量为2mol,故C选项错误;常温常压下气体摩尔体积大于22.4L/mol,可以根据气体体积除以气体摩尔体积求出氯气的物质的量小于1.5mol,由于2Al+3Cl2=2AlCl3~6e—中氯气与转移电子的系数之比等于物质的量之比,则转移电子小于3mol,故D选项错误。
考点:考查考生对阿伏加德罗常数、物质结构、物质的量、摩尔质量、物质的量浓度、气体摩尔体积等概念的了解;考查考生根据物质的量、质量、微粒数目、气体摩尔体积之间的相对关系进行有关计算的能力;考查考生对常见氧化还原反应及其电子转移数的了解。
本题难度:简单
2、选择题 某二价金属的碳酸盐和碳酸氢盐的混合物,跟足量的稀盐酸反应,消耗H+和生成的CO2的物质的量之比为5∶4,则该混合物中碳酸盐和碳酸氢盐的物质的量之比为
A.1∶1
B.1∶2
C.1∶3
D.2∶3
参考答案:D
本题解析:设二者分别为ACO3和A(HCO3)2的物质的量分别为a mol和b mol。由题意知 ,可推出a/b=2:3
,可推出a/b=2:3
本题难度:一般
3、选择题 如图所示,将甲、乙两个装有不同物质的针筒用导管连接起来,将乙针筒内的物质压到甲针筒内,进行下表所列的不同实验(气体在同温同压下测定).
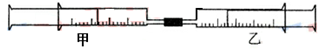
则下列说法正确的是
A.实验1中沉淀最终变为红褐色
B.实验2中甲针筒内的现象是气体颜色变深,且活塞向内移动
C.实验3中甲针筒内气体颜色变深,活塞向内压缩
D.实验4中甲针筒内除有白烟产生外,活塞最终可能向内压缩到尽头
参考答案:C
本题解析:分析:A、氨气与硝酸银溶液反应生成氢氧化银,氢氧化银与氨水反应生成氢氧化二氨合银;
B、发生反应2HBr+Cl2=Br2+2HCl,溴挥发形成蒸汽,甲针筒内的现象是气体颜色变深,气体的物质的量增大;
C、发生反应2NO+O2=2NO2,同时存在2NO2?N2O4,气体的物质的量减小;
D、首先3Cl2+2NH3=N2+6HCl,氨气过量再发生NH3+HCl═NH4Cl,故氨气足量发生3Cl2+8NH3=N2+6NH4Cl,据此计算判断.
解答:A、AgNO3+NH3?H2O═AgOH↓+NH4NO3,AgOH为白色沉淀,氨气过量AgOH+2NH3?H2O═[Ag(NH3)2]OH+2H2O,沉淀消失,故A错误;
B、发生反应2HBr+Cl2=Br2+2HCl,二者恰好反应,溴挥发形成蒸汽,甲针筒内气体颜色变深,气体的物质的量增大,活塞向外移动,故B错误;
C、发生反应2NO+O2=2NO2,同时存在2NO2?N2O4,甲针筒内气体颜色变深,气体的物质的量减小,活塞向内压缩,故A正确;
D、氯气与氨气体积之比为15mL:40mL=3:8,发生反应3Cl2+8NH3=N2+6NH4Cl,生成氮气15mL×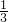 =5mL,有白烟产生外,活塞最终不可能向内压缩到尽,故D错误;
=5mL,有白烟产生外,活塞最终不可能向内压缩到尽,故D错误;
故选C.
点评:本题考查氨气、氯气、氮的氧化物等性质,难度中等,C选项中为易错点,注意存在的平衡.
本题难度:简单
4、选择题 常温下,下列溶液可用铁制或铝制容器盛装的是
A.浓盐酸
B.浓硝酸
C.稀硫酸
D.稀盐酸
参考答案:B
本题解析:分析:根据铁或铝的性质进行解答,能持续发生反应则不能用铁或铝制容器来盛放.
解答:A、盐酸是弱氧化性的酸,能和铁铝反应生成氢气,不能用铁铝制品容器盛放,故A错误;
B、常温下,铁铝在浓硝酸中发生钝化现象,故铁铝制品容器可以盛放浓硝酸,故B正确.
C、稀硫酸有弱氧化性,能和铁铝反应生成氢气,不能用铁铝制品容器盛放,故C错误;
D、稀盐酸是非强氧化性的酸,能和铁铝反应,不能用铝制品容器盛放,故D错误;
故选B.
点评:本题考查了铁铝的化学性质,铁、铝都能和浓硫酸、浓硝酸在常温下发生钝化现象,所以可用铁、铝制容器盛放浓硫酸、浓硝酸.
本题难度:一般
5、选择题 下列各组分子中,都属于含极性键的非极性分子的是
A.CO2H2S
B.C2H4CH4
C.C60 C2H4
D.NH3 HCl
参考答案:B
本题解析:试题分析:A项:H2S中不是非极性分子,故不选;C项:C60中无极性键,故不选;D项:NH3、HCl都是极性分子,故不选。故选B。
考点:极性键和非极性键 极性分子和非极性分子
点评:本题考查的是极性键和非极性键、极性分子和非极性分子的相关知识,题目难度不大,掌握各个化学用语的含义是解题的关键。
本题难度:一般