微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示。已知:pM=-lgc(M),p(CO )=-lgc(CO
)=-lgc(CO )。下列说法正确的是( )
)。下列说法正确的是( )
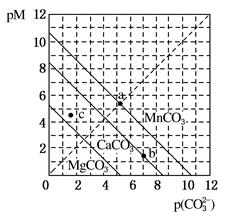
A.MgCO3、CaCO3、MnCO3的Ksp依次增大
B.a点可表示MnCO3的饱和溶液,且c(Mn2+)>c(CO )
)
C.b点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO )
)
D.c点可表示MgCO3的不饱和溶液,且c(Mg2+)<c(CO )
)
参考答案:D
本题解析:
试题分析:A.pM相等时,图线中p(CO32-)数值越大,实际浓度越小,因此,MgCO3、CaCO3、MnCO3的Ksp依次减小,A错误;B.a点可表示MnCO3的饱和溶液,pM=p(CO32-),所以c(Mn2+)=c(CO32-),B错误;C.b点可表示CaCO3的饱和溶液,pM>p(CO32-),所以c(Ca2+)<c(CO32-),C错误;D.pM数值越小,实际浓度越大,已知c点不在曲线上,而在曲线下面,则c点表示MgCO3 的过饱和溶液,pM>p(CO32-),所以c(Mg2+)<c(CO32-),D正确。
考点:考查难溶电解质的溶解平衡,沉淀转化的实质。
本题难度:一般
2、选择题 25℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.6×10-9.该温度下,下列说法不正确的是( )
A.同浓度的Na2SO4和Na2CO3混合溶液中滴加BaCl2溶液,BaSO4先析出
B.BaCO3的悬浊液中加入少量的新制氯水,c(Ba2+)增大
C.BaSO4和BaCO3共存的悬浊液中
c(SO
2-4
)
c(CO
2-3
)
=1
26
D.BaSO4悬浊液中加入Na2CO3浓溶液,BaSO4不可能转化为BaCO3
参考答案:A.25℃时,Ksp(BaSO4)=1×10-10,Ksp
本题解析:
本题难度:简单
3、选择题 已知锌及其化合物的性质与铝及其化合物相似。如图,横坐标为溶液的pH,纵坐标为Zn2+离子或
[Zn(OH)4]2-离子的物质的量浓度(假设Zn2+离子浓度为10-5mol·L-1时,Zn2+离子已沉淀完全)。下列说法不正确的是
 [???? ] [???? ]
A.往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为:Zn2++4OH-=[Zn(OH)4]2-
B.从图中数据计算可得Zn(OH)2的溶度积Ksp=10-17
C.某废液中含Zn2+离子,沉淀Zn2+离子可以控制溶液pH的范围是8~12
D.向1L 1 mol·L-1ZnCl2溶液中加入NaOH固体至pH=6,需NaOH 0.2mol
参考答案:D
本题解析:
本题难度:一般
4、选择题 常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是(??)
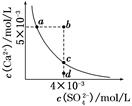
A.在任何溶液中,c(Ca2+)、c(SO42-)均相等
B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol/L
C.a点对应的Ksp等于c点对应的Ksp
D.d点溶液通过蒸发可以变到c点
参考答案:C
本题解析:A项只有在单一CaSO4溶液中c(Ca2+)、c(SO42-)才相等,A项错误;B项b点Qc>Ksp,故有沉淀生成,开始c(Ca2+)、c(SO42-)不相等而反应消耗的Ca2+、SO42-相等,因此平衡后的两种离子也不会都等于3×10-3 mol/L,B项错误;在平衡线上的Ksp均相等,C项正确;D项d点通过蒸发后各离子浓度都增大,不可能保持SO42-浓度不变而到达c点,D项错误。
本题难度:一般
5、选择题 某温度下,已知Ksp(AgCl)=1.56×10—10,Ksp(AgBr)=7.7×10—13,Ksp(Ag2CrO4)=9.0×10—12。某溶液中含有Cl—、Br—、CrO42—,浓度均为0.010 mol/L,向该溶液中逐滴加入0.010 mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
A.Cl—、Br—、CrO42—
B.CrO42—、Br—、Cl—
C.Br—、Cl—、CrO42—
D.Br—、CrO42—、Cl—
参考答案:C
本题解析:
试题分析:当 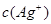 与 与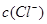 的积超过1.56×10—10有沉淀,当 的积超过1.56×10—10有沉淀,当 本题难度:简单 本题难度:简单
|
网站客服QQ: 960335752 - 14613519 - 791315772
|