微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量关系可表示为( )
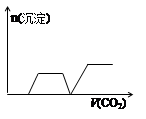
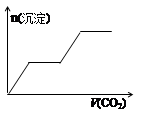
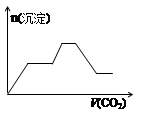
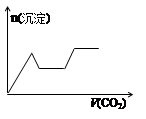
A B C D
参考答案:C
本题解析:
试题分析:将二氧化碳气体通入含有氢氧化钾,氢氧化钡,KAlO2的混合溶液中,生成沉淀的量和通入二氧化碳的量的关系以二氧化碳的体积为横坐标,以沉淀的物质的量为纵坐标的图象的画法,可以做如下分析:CO2先与Ba(OH)2反应(有沉淀BaCO3生成),当Ba(OH)2消耗完毕后再与KOH反应(此时无沉淀);最后与KAlO2反应(有沉淀Al(OH)3生成),以上过程中图形应是:出现沉淀(BaCO3),平台,沉淀增加[因有Al(OH)3生成];过量的CO2还可以继续与K2CO3反应得到KHCO3,继续过量的CO2还可以使BaCO3沉淀溶解,最后是Al(OH)3沉淀,所以接着的图形应该为:平台,沉淀(BaCO3)减少,平台,故整个过程的图形应为:出现沉淀(BaCO3),平台,沉淀增加[因有Al(OH)3生成],平台,沉淀(BaCO3)减少,平台,满足以上关系的图象为C,故选:C。
考点:考查二氧化碳通入混合溶液中的反应顺序
本题难度:一般
2、选择题 下列离子方程式中,正确的是 ( )
A.NaAlO2溶液中通入少量二氧化碳:
AlO2-+ CO2 + 2H2O = Al(OH) 3↓+ HCO3-
B.高锰酸钾酸性溶液与草酸溶液反应:
2MnO4-+ 5C2O42-+ 16H+=2Mn2+ + 10CO2↑+ 8H2O
C.用稀硫酸除去铁片表面的铁锈:FeO + 2H+ = Fe2+ + H2O
D.用惰性电极电解饱和食盐水:2C1- + 2H2O  Cl2↑ + H2↑ + 2OH-
Cl2↑ + H2↑ + 2OH-
参考答案:D
本题解析:略
本题难度:一般
3、选择题 能正确表示下列反应的离子方程式是 ( )
A.溴化亚铁溶液中通入足量氯气:2Fe2++2Br—+2Cl2===2Fe3++Br2+2Cl—

B.向次氯酸钙溶液通入SO2:Ca2++2ClO—+SO2+H2O=== CaSO3↓+2HClO

C.四氧化三铁与稀硝酸反应:Fe3O4+8H+===Fe2++ 2Fe3+ H2O
D.Cl2与石灰水反应:Cl2+2OH-===Cl-+ClO-+H2O
参考答案:D
本题解析:
试题分析:A.原子、电荷不守恒,正确的为2Fe2++2Br—+2Cl2===2Fe3++Br2+4Cl—,A不正确;
 B.SO2具有还原性,ClO—具有氧化性,会发生氧化还原反应:Ca2++2ClO—+2SO2+2H2O=== CaSO4↓+4H++Cl—+ SO42—,B不正确;
B.SO2具有还原性,ClO—具有氧化性,会发生氧化还原反应:Ca2++2ClO—+2SO2+2H2O=== CaSO4↓+4H++Cl—+ SO42—,B不正确;
 C.稀硝酸具有强氧化性,可将亚铁离子氧化:Fe3O4+10H++NO3—===3Fe3+ +5H2O+NO2↑,C不正确;
C.稀硝酸具有强氧化性,可将亚铁离子氧化:Fe3O4+10H++NO3—===3Fe3+ +5H2O+NO2↑,C不正确;
D.Cl2与石灰水反应:Cl2+2OH-===Cl-+ClO-+H2O反应的离子方程式正确,故选D。
考点:离子方程式的书写;氧化还原反应
点评:本题考查离子方程式的书写及氧化还原反应,有一定难度,解答本题应熟悉离子方程式的书写和各种物质的化学性质。
本题难度:困难
4、选择题 下列反应的离子方程式中写不正确的是( )
A.石灰石溶于盐酸:CaCO3+2H+
参考答案:
本题解析:
本题难度:简单
5、填空题 (5分)某大理石含有的主要杂质是氧化铁,以下是提纯该大理石的实验步骤:
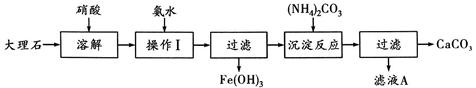
(1)溶解大理石时,用硝酸而不用硫酸的原理是: 。
(2)操作Ⅰ的目的是: ,该反应的离子方程式是: 。
(3)写出加入(NH4)2CO3所发生反应的离子方程式: ,
滤液A的一种用途是 。
参考答案:(1) 硫酸钙微溶于水。
(2) 除Fe3+离子;Fe
本题解析:
试题分析:溶解大理石时,用硝酸而不用硫酸的原理是因为硫酸钙微溶于水,如果用硫酸则不会使碳酸钙完全溶解;加氨水的目的是除去杂质Fe3+,离子方程式为: Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+;加入(NH4)2CO3目的是使Ca2+沉淀Ca2++CO32- =CaCO3↓,滤液A的主要成分是NH4NO3可做氮肥。
考点:工艺流程推断。
本题难度:一般