微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组离子或分子能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是 ( )
选项
| 离子组
| 加入试剂
| 加入试剂后发生反应的离子方程式
|
A
| NH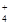 、Fe2+、SO 、Fe2+、SO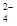
| 少量Ba(OH)2溶液
| 2NH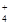 +SO +SO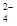 +Ba2++2OH-===BaSO4↓+2NH3·H2O +Ba2++2OH-===BaSO4↓+2NH3·H2O
|
B
| Mg2+、HCO 、Cl- 、Cl-
| 过量NaOH溶液
| Mg2++2HCO +4OH-===2H2O+Mg(OH)2↓+2CO +4OH-===2H2O+Mg(OH)2↓+2CO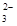
|
C
| K+、NH3·H2O、CO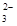
| 通入少量CO2
| 2OH-+CO2===CO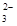 +H2O +H2O
|
D
| Fe2+、NO 、HSO 、HSO
| NaHSO4溶液
| HSO +H+===SO2↑+H2O +H+===SO2↑+H2O
参考答案:B
本题解析:
试题分析:A选项亚铁离子也可以与氢氧根离子反应生成白色沉淀氢氧化亚铁故A选项是错误的。C选项氨水是弱电解质,在书写离子反应方程式时不能写成离子的形式D选项亚铁离子在有硝酸存在的条件下会被氧化所以答案选B
考点:考查离子反应的相关知识点
本题难度:一般
2、选择题 下列离子方程式书写正确的是
A.过量的SO2通入NaOH溶液中:SO2+2OH-=SO32-+H2O
B.Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2
C.NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O
D.NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32
参考答案:C
本题解析:略
本题难度:一般
3、选择题 下列化学反应的离子方程式书写不正确的是
A.碳酸钙与盐酸的反应:CaCO3 +2H+ =Ca2++ CO2↑+ H2O
B.等物质的量的MgCl2、Ba(OH)2和HCl溶液混合: Mg2++2OH-=Mg(OH)2↓
C.氧化铜与稀H2SO4反应:CuO+2H+ =Cu2+ + H2O
D.金属钠跟水反应: 2Na+2H2O=2Na++ 2OH- +H2↑
参考答案:B
本题解析:
试题分析:等物质的量的MgCl2、Ba(OH)2和HCl溶液混合,离子方程式为H++ OH-= H2O,选B。
考点:考查离子方程式的正误判断。
本题难度:一般
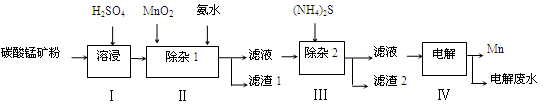
4、简答题 (12分)锰的用途非常广泛,在钢铁工业中,锰的用量仅次于铁,90%的锰消耗于钢铁工业,10%的锰消耗于有色冶金、化工、电子、电池、农业等部门。以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:
已知25℃,部分物质的溶度积常数如下:
物质
| Mn(OH)2
| Co(OH)2
| Ni(OH)2
| MnS
| CoS
| NiS
| Ksp
| 2.1×10-13
| 3.0×10-16
| 5.0×10-16
| 1.0×10-11
| 5.0×10-22
| 1.0×10-22
(1)步骤Ⅰ中,MnCO3与硫酸反应的化学方程式是 。
(2)步骤Ⅰ中需要加入稍过量的硫酸,其目的有3点:①使矿物中的物质充分反应;②提供第Ⅱ步氧化时所需要的酸性环境;③ 。
(3)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,该反应的离子方程式是 ,加氨水调节溶液的pH为5.0~6.0,以除去Fe3+。
(4)步骤Ⅲ中,滤渣2的主要成分是 。
(5)步骤Ⅳ中,在 (填“阴”或“阳”)极析出Mn,电极反应方程式为 。
(6)电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降。欲使溶液中c(Mn2+)≤1.0×10-5 mol·L-1,则应保持溶液中c(S2-)≥ mol·L-1。
参考答案:(12分)
(1)MnCO3+H2SO4 =MnSO4
本题解析:
试题分析:(1)碳酸锰与硫酸反应生成硫酸锰、二氧化碳和水,所以化学方程式是MnCO3+H2SO4 =MnSO4+ CO2↑+H2O;
(2)根据表中数据可知氢氧化锰是弱碱,所以硫酸锰水解生成氢氧化锰和硫酸,则硫酸过量的第三个作用是抑制锰离子水解;
(3)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,二氧化锰被还原为锰离子,离子方程式是MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(4)根据流程图可知,除杂1时,将铁离子除去,则除杂2的目的是除去镍离子和钴离子,根据沉淀的溶度积可知,加入硫化铵后,镍离子和钴离子已硫化物的沉淀除去,所以滤渣2的主要成分是CoS和NiS;
(5)电解时,锰离子在阴极发生还原反应,所以Mn在阴极析出;电极反应式是Mn2++2e-=Mn;
(6)因为KMnS=1.0×10-11,所以欲使溶液中c(Mn2+)≤1.0×10-5 mol·L-1,则应保持溶液中c(S2-)≥KMnS/ c(Mn2+)=1×10-6 mol/L。
考点:考查对工业流程的分析,溶度积的应用,离子方程式的书写
本题难度:困难
5、选择题 下列叙述中正确的是
A.Al、Fe、Cu三者对应的氧化物均为碱性氧化物
B.Fe3+有氧化性,所以可以用FeCl3溶液来回收旧电路板中的铜
C.向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O===2Al(OH)3↓+CO32-
D.加入铝粉能产生H2的溶液中,一定存在大量的Na+、Ba2+、AlO2-、Cl-
参考答案:B
本题解析:
试题分析:
A、铝对应的氧化物Al2O3是两性氧化物,故A错误;
B、Fe3+有氧化性,所以可用FeCl3溶液与铜反应,回收旧电路板中的铜,故B正确;
C、向NaAlO2溶液中通入过量CO2,应得到HCO3-而不是CO32-,故C不正确;
D、加入铝粉能产生H2的溶液中,可能存在大量的H+或OH-,而AlO2-与H+或不能大量共存,故D不正确。
考点:考查铝铁铜及其化合物的性质
点评:本题考查了铝铁铜及其化合物的性质,难度不大。对铝及其化合物的两性在习题中的考查要特别注意。
本题难度:一般
|
|