微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 25℃,101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518
kJ/mol。下列热化学方程式书写正确的是[???? ]
A. 2H+(aq)+SO42-(aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(l) △H=-57.3 kJ/mol
B. KOH(aq)+1/2H2SO4(aq)=1/2K2SO4(aq)+H2O(l) △H=-57. 3 kJ/mol
C. C8H18(l)+25/2O2(g)=8CO2(g)+9H2O( g) △H=-5518kJ/mol
D. 2C8H18(g)+25O2(g)=16CO2(g)+18H2O(l) △H=-5 518 kJ/mol
参考答案:B
本题解析:
本题难度:简单
2、填空题 (8分) 已知某反应A(g)+B(g)?C(g)+D(g)进行过程中的能量变化如图所示,请回答下列问题:
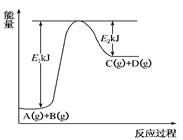
(1)该反应的ΔH=________kJ·mol-1(用含E1、E2的代数式表示)。(1分)
(2)若在反应体系中加入催化剂使逆反应速率增大,则E1________(填“增大”、“减小”或“不变”,下同),ΔH________。(2分)
(3)在相同温度和压强下,对反应A(g)+B(g)
参考答案:
本题解析:
本题难度:一般
3、填空题 (13分)碳、硫的含量影响钢铁性能。碳、硫含量的一种测定方法是将钢样中的碳、硫转化为气体,再用测碳、测硫装置进行测定。
(1)采用装置A,在高温下将x g钢样中的碳、硫转化为CO2、SO2。
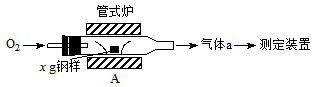
①气体a的成分是______。
②若钢样中硫以FeS形式存在,A中反应:3FeS+5O2 1________+3________。
1________+3________。
(2)将气体a通入测硫装置中(如图),采用滴定法测定硫的含量。
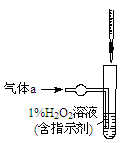
①H2O2氧化SO2的化学方程式:__________________。
②用NaOH溶液滴定生成的H2SO4,消耗z mL NaOH溶液。若消耗1 mL NaOH溶液相当于硫的质量为y g,则该钢样中硫的质量分数:________。
(3)为了减少空气中SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。已知:2H2(g)+O2(g)=2H2O(g) ΔH1=-d kJ·mol-1;
2C(s)+O2(g)=2CO(g) ΔH2=-e kJ·mol-1;
碳的燃烧热为f kJ·mol-1(d、e、f均大于0);
写出CO与水蒸气反应生成CO2和H2的热化学方程式:_______________________。
②将含SO2的烟气通过洗涤剂Y,再加入稀硫酸,既可以回收SO2,同时又可以得到化肥,上述洗涤剂Y可以是_______(填序号)。
a.Ca(OH)2 b.CaCl2 c.K2CO3 d.NaHSO3 e.NH3·H2O
参考答案:(1)①SO2、CO2、O2(2分)
本题解析:
试题分析:(1)①钢样中的碳、硫在装置A中被氧化为CO2、SO2,故a的成分为CO2、SO2以及未反应的O2;②FeS中的,-2价的硫被氧化为SO2,+2价的Fe被氧化为+3价的铁,结合所给化学计量数,可知产物应为Fe3O4和SO2,故方程式为3FeS+5O2=Fe3O4+3SO2。(2)①H2O2具有氧化性,可氧化SO2使S的化合价升高为+6价,在溶液中反应产物应为硫酸,故反应方程式为:H2O2+SO2=H2SO4;②1mL NaOH相当于yg S,故z mL NaOH相当于 zy g S,则该样品中硫的质量分数为(yz)/x×100%。(3)①碳的燃烧热化学方程式为C(s)+O2(g)=CO2(g) ΔH2=-f kJ·mol-1,根据盖斯定律,三个方程式进行加和,3式-1式÷2-2式÷2,得出ΔH=0.5d+0.5e-f kJ·mol-1,所以写热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=0.5d+0.5e-f kJ·mol-1;②碳酸钾吸收二氧化硫生成亚硫酸钾,又与硫酸反应生成二氧化硫和硫酸钾,硫酸钾可以做化肥,氨水可以吸收二氧化硫,转化为亚硫酸铵,与硫酸反应生成二氧化硫和硫酸铵,硫酸铵可以做氮肥,故选ce。
考点:本题考查碳、硫的测定原理及方法。
本题难度:困难
4、选择题 已知:
(1)H2(g)+1/2O2(g)===H2O(g) ΔH1=a kJ/mol
(2)2H2(g)+O2(g)===2H2O(g) ΔH2=b kJ/mol
(3)H2(g)+1/2O2(g)===H2O(l) ΔH3=c kJ/mol
(4)2H2(g)+O2(g)===2H2O(l) ΔH4=d kJ/mol
下列关系式中正确的是[???? ]
A.a<c<0
B.b>d>0
C.2a=b<0
D.2c=d>0
参考答案:C
本题解析:
本题难度:一般
5、选择题 研究CO、SO2、NO等大气污染气体的综合处理与利用具有重要意义。
(1)以CO或CO2与H2为原料,在一定条件下均可合成甲醇,你认为用哪种合成设计线路更符合“绿色化学”理念:(用化学反应方程式表示) 。
(2)如图所示是用于合成甲醇产品中甲醇含量的检测仪。写出该仪器工作时的电极反应式:

负极 ,正极 。
(3)一定条件下,NO2和SO2反应生成SO3(g)和NO两种气体,现将体积比为1:2的NO2和SO2的混合气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。(填序号)
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO3、NO的体积比保持不变
D.每消耗 1 mol SO2,同时生成1 mol NO
当测得上述平衡体系中NO2与SO2体积比为1:6时,则该反应平衡常数K值为 ;
(4)工业常用Na2CO3饱和溶液回收NO、NO2气体:
NO+NO2+Na2CO3=2NaNO2+CO2 2NO2+Na2CO3=NaNO3+NaNO2+CO2
若用足量的Na2CO3溶液完全吸收NO、NO2混合气体,每产生标准状况下CO2 2.24L(CO2气体全部逸出)时,吸收液质量就增加4.4g,则混合气体中NO和NO2体积比为 。
参考答案:(1)CO(g)+2H2(g) 本题解析:
本题解析:
(1)因为化学反应的过程就是原子重新组合的过程,由于“绿色化学”就是反应物的原子完全转化为目标生成物,所以使用CO、H2来制取CH3OH 。反应的方程式为:CO(g)+2H2(g) CH3OH(g)。(2)左边通入甲醇的电极为负极,电极反应为:2CH3OH-12e-+2H2O=2CO2+12H+;右边通入O2的电极为正极,由于是酸性介质,发生的电极反应为:3O2+12e-+12H+=6H2O。(3)NO2和SO2反应生成SO3(g)和NO的方程式为:NO2+SO2
CH3OH(g)。(2)左边通入甲醇的电极为负极,电极反应为:2CH3OH-12e-+2H2O=2CO2+12H+;右边通入O2的电极为正极,由于是酸性介质,发生的电极反应为:3O2+12e-+12H+=6H2O。(3)NO2和SO2反应生成SO3(g)和NO的方程式为:NO2+SO2 SO3(g)+NO.A.该反应是反应前后气体体积相等的可逆反应,所以无论反应是否达到平衡,反应的压强都不会发生变化。B.由于容器的容积不变,若反应达到平衡,任何物质的物质的量不变,NO2是有色的物质,其浓度不变,所以混合气体颜色保持不变。因此该反应达到平衡。正确。C.发生反应NO2+SO2
SO3(g)+NO.A.该反应是反应前后气体体积相等的可逆反应,所以无论反应是否达到平衡,反应的压强都不会发生变化。B.由于容器的容积不变,若反应达到平衡,任何物质的物质的量不变,NO2是有色的物质,其浓度不变,所以混合气体颜色保持不变。因此该反应达到平衡。正确。C.发生反应NO2+SO2 SO3(g)+NO ,每产生SO31mol,必然同时产生NO1mol。因此无论反应是否达到平衡,SO3、NO的体积比始终保持不变。故不能作为反应达到平衡的标志。错误。D.SO2是反应物,NO为生成物,方程式中二者的物质的量的比为1:1,所以每消耗 1 mol SO2,同时生成1 mol NO ,与反应是否达到平衡无关,因此不能作为反应达到平衡的标志。错误。假设反应开始时,n(NO2)="amol;" n(SO2)=2amol.。在反应过程中?n(NO2)="xmol" ,则?n(SO2)=xmol,则达到平衡是反应NO2+SO2
SO3(g)+NO ,每产生SO31mol,必然同时产生NO1mol。因此无论反应是否达到平衡,SO3、NO的体积比始终保持不变。故不能作为反应达到平衡的标志。错误。D.SO2是反应物,NO为生成物,方程式中二者的物质的量的比为1:1,所以每消耗 1 mol SO2,同时生成1 mol NO ,与反应是否达到平衡无关,因此不能作为反应达到平衡的标志。错误。假设反应开始时,n(NO2)="amol;" n(SO2)=2amol.。在反应过程中?n(NO2)="xmol" ,则?n(SO2)=xmol,则达到平衡是反应NO2+SO2 SO3(g)+NO平衡体系中n(NO2)=(a-x)mol;n(SO2)=(2a-x)mol;n(SO3)=xmol;n(NO)=xmol。由于平衡时NO2与SO2体积比为1:6,所以(a-x):(2a-x)=1:6.解得
SO3(g)+NO平衡体系中n(NO2)=(a-x)mol;n(SO2)=(2a-x)mol;n(SO3)=xmol;n(NO)=xmol。由于平衡时NO2与SO2体积比为1:6,所以(a-x):(2a-x)=1:6.解得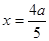 .所以在该温度下该反应平衡常数
.所以在该温度下该反应平衡常数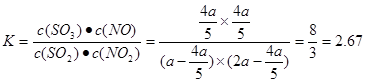 。(4)由方程式可以看出:每产生1mol的CO2,消耗混合气体2mol。现在产生2.24L标志状况下的CO2,即产生0.1 mol CO2,所以消耗气体0.1mol..则混合气体的摩尔质量为44g/mol.假设NO为xmol, NO2为(1-x)mol.30x+46(1-x)=44.则x:(1-x)=1:7.
。(4)由方程式可以看出:每产生1mol的CO2,消耗混合气体2mol。现在产生2.24L标志状况下的CO2,即产生0.1 mol CO2,所以消耗气体0.1mol..则混合气体的摩尔质量为44g/mol.假设NO为xmol, NO2为(1-x)mol.30x+46(1-x)=44.则x:(1-x)=1:7.
本题难度:一般