微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 20℃时H2S饱和溶液1 L,其浓度为0.1 mol / L,若要使溶液的pH和c(S2-)减小,可采取的措施是???(????)
A.加入适量的CuSO4固体
B.加入少量的氢氧化钠固体
C.通入适量的H2S气体
D.加入适量水
参考答案:A
本题解析:
试题分析:H2S是弱电解质,存在电离平衡,即H2S HS-+H+、HS-
HS-+H+、HS- S2-+H+。硫酸铜能和H2S反应生
S2-+H+。硫酸铜能和H2S反应生
本题难度:简单
2、简答题 回收的废旧锌锰干电池经过处理后得到锰粉(含MnO2、Mn(OH)2、Fe、NH4Cl和炭黑等),由锰粉制取MnO2的步骤如图所示:
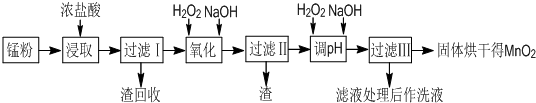
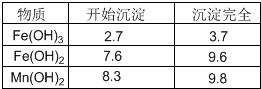
根据上图所示步骤并参考左边表格数据回答问题:
(1)在加热条件下用浓盐酸浸取锰粉,所得溶液中含有Mn2+、Fe2+等.MnO2与浓盐酸反应的离子方程式为______;这种处理方法不足之处为:______.
(2)锰粉经浓盐酸浸取,过滤I除去不溶杂质后,向滤液中加入足量H2O2溶液,其作用是______.
(3)过滤I的滤渣的化学式为______.过滤Ⅱ的滤渣的化学式为______.
(4)将过滤I所得滤液经H2O2氧化后,再加入NaOH溶液调节pH的范围是______:,其目的是______.
(5)过滤Ⅱ所得滤液加入足量H2O2溶液并加入NaOH溶液调节pH约为9,使Mn2+氧化得到MnO2,反应的离于方程式为______.
参考答案:(1)MnO2具有强氧化性,与浓盐酸反应生成氯气,反应的离子
本题解析:
本题难度:一般
3、实验题 在进行研究性学习的过程中,某同学把AgNO3溶液滴入K2HPO4溶液,即得黄色沉淀。经过查阅资料得知:K2HPO4溶液呈碱性;Ag2HPO4和Ag3PO4为黄色沉淀,只是Ag2HPO4的颜色略浅。该同学认为不能简单地根据颜色的深浅,来确定沉淀是何物。为此,他设计了一个分析实验的方案:
先测K2HPO4溶液的pH;在K2HPO4溶液中滴加硝酸银溶液的同时,不断测定溶液的pH,直到沉淀量达到最大为止。实际实验中,随着AgNO3溶液的滴入,溶液的pH最终为3~4之间。
(1)请你判断沉淀量达到最大值时的黄色沉淀是____(填“Ag3 PO4”或“Ag2 HPO4”)。
(2)根据上述实验结果,请写出K2HPO4与AgNO3反应的化学方程式:_____
(3)请你写出该实验的分析方案中是怎样得出实验结果的:____
参考答案:(1) Ag3PO4
(2)3AgNO3+K2HPO4
本题解析:
本题难度:一般
4、选择题 下列说法中不正确的是(????)
A.Ksp只与难溶电解质本身的性质和温度有关
B.在一定温度下的AgCl饱和溶液中,C(Ag+)和C(Cl-)的乘积是一个常数
C.在一定温度下,向AgCl饱和溶液中加入盐酸时,Ksp值变大
D.由于Ksp(FeS)>Ksp(CuS),所以FeS沉淀在一定条件下可以转化为CuS沉淀
参考答案:C
本题解析:
试题分析:Ksp只与难溶电解质本身的性质和温度有关,所以A正确,在一定温度下的AgCl饱和溶液中,C(Ag+)和C(Cl-)的乘积是一个常数,所以B也正确;在一定温度下,向AgCl饱和溶液中加入盐酸时,由于温度不变,所以Ksp值不变,所以C不正确,为本题的正确答案;由于Ksp(FeS)>Ksp(CuS),所以FeS沉淀在一定条件下可以转化为CuS沉淀,故D正确。
点评:本题考查了溶解度,溶解度常数,考生要注意温度不变,物质的溶解度常数不变,本题比较容易。注意本题是选择说法不正确的。
本题难度:一般
5、填空题 一水草酸钙(CaC2O4·H2O)可用作分离稀有金属的载体。其制备方法如下:
步骤I:用精制氯化钙稀溶液与草酸溶液共热反应,过滤,将固体溶于热盐酸中。
步骤Ⅱ:加氨水反应得一水草酸钙沉淀,过滤,热水洗涤,在105℃干燥得产品。
(1)写出步骤Ⅱ发生反应的化学方程式 。
(2)已知CaC2O4·H2O的Ksp = 2.34×10-9,为使步骤Ⅱ溶液中c(C2O42-)≤1×10-5 mol·L-1,c(Ca2+)的范围为 。
(3)为研究一水草酸钙的热分解性质,进行如下实验:准确称取36.50g样品加热,样品的固体残留率( )随温度的变化如下图所示。
)随温度的变化如下图所示。

①300℃时残留固体的成分为 ,900℃时残留固体的成分为 。
②通过计算求出500℃时固体的成分及质量。(写出计算过程)
参考答案:(1)H2C2O4+CaCl2+2NH3?H2O=CaC2O
本题解析:
试题分析:在步骤I得到精制H2C2O4和CaCl2,然后向该溶液中加入浓氨水发生反应产生一水合草酸钙。发生该反应的方程式是:H2C2O4+CaCl2+2NH3?H2O=CaC2O4?H2O↓+2NH4Cl+H2O;(2)由于CaC2O4·H2O的Ksp = c(C2O42-)×c(Ca2+)=2.34×10-9,所以为使步骤Ⅱ溶液中c(C2O42-)≤1×10-5 mol·L-1,c(C2O42-)×c(Ca2+)≥2.34×10-9,
(Ca2+)>2.34×10-9÷1×10-5 mol/L =2.34×10-4mol/L。即c(Ca2+)的范围为≥2.34×10-4mol/mol;(3)CaC2O4·H2O 可能发生的分解反应是:CaC2O4·H2O CaC2O4·H2O,146g CaC2O4·H2O完全分解产生128g CaC2O4, 样品的固体残留率是(128g÷146g)×100%=87.67%,所以在300℃时残留固体的成分为CaC2O4;CaC2O4·H2O
CaC2O4·H2O,146g CaC2O4·H2O完全分解产生128g CaC2O4, 样品的固体残留率是(128g÷146g)×100%=87.67%,所以在300℃时残留固体的成分为CaC2O4;CaC2O4·H2O CaCO3+CO↑+ H2O, 样品的固体残留率是(100g÷146g)×100%=68.49%, CaC2O4·H2O
CaCO3+CO↑+ H2O, 样品的固体残留率是(100g÷146g)×100%=68.49%, CaC2O4·H2O CaO+CO2↑+CO↑+H2O。(56g÷146g) ×100%=38.36%,所以在900℃时残留固体的成分为CaO;由于在500℃时固体残留率是87.67%,>76.16%>68.49%;所以固体中应该含有的CaC2O4和CaCO3。样品中CaC2O4?H2O的物质的量为n(CaC2O4?H2O)="36." 50g/146g/ mol=0.25mol;设混合物中CaC2O4和CaCO3的的物质的量分别是xmol和ymol,根据500℃时固体总质量,可得128x+100y="36." 50g×76.16%;根据Ca元素守恒,可得x+y=0.25.解放出组可得x=0.1,y="0.15" 。m(CaC2O4)=0.1mol×128g/mol=12.8g;m(CaCO3)= 0.15mol×100g/mol=15.0g。
CaO+CO2↑+CO↑+H2O。(56g÷146g) ×100%=38.36%,所以在900℃时残留固体的成分为CaO;由于在500℃时固体残留率是87.67%,>76.16%>68.49%;所以固体中应该含有的CaC2O4和CaCO3。样品中CaC2O4?H2O的物质的量为n(CaC2O4?H2O)="36." 50g/146g/ mol=0.25mol;设混合物中CaC2O4和CaCO3的的物质的量分别是xmol和ymol,根据500℃时固体总质量,可得128x+100y="36." 50g×76.16%;根据Ca元素守恒,可得x+y=0.25.解放出组可得x=0.1,y="0.15" 。m(CaC2O4)=0.1mol×128g/mol=12.8g;m(CaCO3)= 0.15mol×100g/mol=15.0g。
考点:考查温度对物质分解产物成分的影响、溶度积常数的应用、物质化学性质的方程式表示、混合物中各组分含量的计算的知识。
本题难度:困难