微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,pH=13的强碱溶液与pH=2的强酸溶液混合,所得溶液的pH=11,则强碱与强酸的体积比
A.11∶1
B.9∶1
C.1∶11
D.1∶9
2、选择题 下列叙述正确的是
A.c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系是:
c[(NH4)2Fe(SO4)2]<c[(NH4)2SO4]<c(NH4Cl)
B.若0.3 mol/L HY溶液与0.3 mol/L NaOH溶液等体积混合后,溶液的pH=9,则
c(OH-)-c(HY)=c(H+)=1×10-5mol/L
C.0.2mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH=1
D.NaHCO3溶液中:c(H+)+c(H2CO3)=c(CO32-)+c(OH-)
3、选择题 25?℃时,水的电离达到平衡:H2O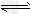 H++OH-;ΔH>0,下列叙述正确的是[???? ]
H++OH-;ΔH>0,下列叙述正确的是[???? ]
A.向水中加入稀氨水,水的电离程度增大
B.向水中加入少量固体醋酸钠,平衡逆向移动,c(H+)降低
C.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
D.将水加热,平衡逆向移动
4、填空题 (12分)草酸与高锰酸钾在酸性条件下能够发生如下反应:
2MnO4- + 5H2C2O4 +6H+ =2Mn2+ +10CO2↑ +8H2O
用4mL0.001mol/LKMnO4溶液与2mL0.01mol/LH2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
组别
| 10%硫酸溶液的体积/mL
| 温度/℃
| 其他物质
|
Ⅰ
| 2mL
| 20
| 无
|
Ⅱ
| 2mL
| 20
| 10滴饱和MnSO4溶液
|
Ⅲ
| 2mL
| 30
| 无
|
Ⅳ
| 1mL
| 20
| 1mL蒸馏水
(1)如果研究催化剂对化学反应速率的影响,应使用实验 和 (用Ⅰ~Ⅳ表示,下同);如果研究温度对化学反应速率的影响,应使用实验 和 。
(2)对比实验Ⅰ和Ⅳ,可以研究 对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是 。
(3)在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度。在H2SO4溶液中,反应如下:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
①用托盘天平称取W g Na2C2O4晶体。
②将WgNa2C2O4配成100 mL标准溶液,量取20.00 mL置于锥形瓶中,
酸性KMnO4溶液应装在________(填“酸式”或“碱式”)滴定管中。
③若滴定管的起始读数和终点读数如图所示,则酸性KMnO4的物质的浓度为________ (填表达式,用W表示)。
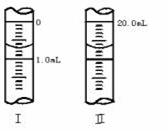
5、选择题 已知:常温下氢氟酸Ka=3.5×10-4,醋酸Ka=1.8×10-5,能正确描述在它们的钠盐溶液中,水电离出的c(H+)与盐浓度的关系曲线的是( )
|