微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下,pH=13的强碱溶液与pH=2的强酸溶液混合,所得溶液的pH=11,则强碱与强酸的体积比
A.11∶1
B.9∶1
C.1∶11
D.1∶9
参考答案:D
本题解析:
试题分析:混合后pH=11,则溶液中OH-的浓度是10-3mol/L,则(0.1V1-0.01V2)÷(V1+V2)=0.001,解得V1
本题难度:一般
2、选择题 下列叙述正确的是
A.c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系是:
c[(NH4)2Fe(SO4)2]<c[(NH4)2SO4]<c(NH4Cl)
B.若0.3 mol/L HY溶液与0.3 mol/L NaOH溶液等体积混合后,溶液的pH=9,则
c(OH-)-c(HY)=c(H+)=1×10-5mol/L
C.0.2mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH=1
D.NaHCO3溶液中:c(H+)+c(H2CO3)=c(CO32-)+c(OH-)
参考答案:AD
本题解析:
试题分析:根据盐的组成可知,溶质浓度相同时,硫酸铵溶液中的铵根离子浓度比氯化铵溶液中的大,而硫酸亚铁铵溶液中的铵根离子浓度比硫酸铵中小,因为亚铁离子的水解反应能抑制铵根离子的水解,则c(NH4+):(NH4)2Fe(SO4)2>(NH4)2SO4>NH4Cl,反之,若三种铵盐溶液中c(NH4+)相等,硫酸亚铁铵浓度保持不变时,则氯化铵浓度增大的程度最大,硫酸铵浓度增大的程度其次,所以溶质浓度大小关系为c[(NH4)2Fe(SO4)2]<c[(NH4)2SO4]<c(NH4Cl),故A选项正确;由于n=c?V,则HY和NaOH的物质的量相等,二者恰好完全中和,生成NaY溶液,由于溶液pH=9,即溶液显碱性,说明NaY是强碱弱酸盐、HY是弱酸,相同,由于c(H+)=10—pHmol/L=10—9mol/L,Kw=c(H+)?c(OH-)=10—14,则该碱性溶液中的溶液中c(OH-)=Kw/c(H+)=10—5mol/L,由于NaY溶液中质子守恒关系式为c(OH-)=c(H+)+c(HY)= 10—5mol/L,故B选项错误;强酸与强碱混合时强酸过量,则混合后溶液中c(H+)=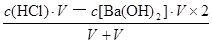 =
=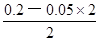 mol/L=0.05mol/L,由于pH="—lg" c(H+),则该溶液pH介于1~2之间,故C选项错误;碳酸氢钠的电离程度远大于水,即NaHCO3=Na++HCO3—、H2O
mol/L=0.05mol/L,由于pH="—lg" c(H+),则该溶液pH介于1~2之间,故C选项错误;碳酸氢钠的电离程度远大于水,即NaHCO3=Na++HCO3—、H2O H++OH—,水电离出的氢离子浓度等于水电离出的氢氧根离子,碳酸氢根离子不仅能水解,而且能电离,即HCO3—+ H2O
H++OH—,水电离出的氢离子浓度等于水电离出的氢氧根离子,碳酸氢根离子不仅能水解,而且能电离,即HCO3—+ H2O H2CO3+OH—、HCO3—
H2CO3+OH—、HCO3— H++ CO32—,前者消耗水电离出的氢离子浓度与生成的碳酸浓度相等,后者消耗水电离出的氢氧根离子浓度与生成的碳酸根离子浓度相等,根据质子守恒原理可得:c(H+)+c(H2CO3)=c(CO32-)+c(OH-),故D选项正确。
H++ CO32—,前者消耗水电离出的氢离子浓度与生成的碳酸浓度相等,后者消耗水电离出的氢氧根离子浓度与生成的碳酸根离子浓度相等,根据质子守恒原理可得:c(H+)+c(H2CO3)=c(CO32-)+c(OH-),故D选项正确。
考点:考查水溶液中粒子浓度大小关系,涉及盐类水解程度大小关系、盐溶液中质子守恒关系式、溶液的pH、水的离子积等。
本题难度:一般
3、选择题 25?℃时,水的电离达到平衡:H2O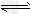 H++OH-;ΔH>0,下列叙述正确的是[???? ]
H++OH-;ΔH>0,下列叙述正确的是[???? ]
A.向水中加入稀氨水,水的电离程度增大
B.向水中加入少量固体醋酸钠,平衡逆向移动,c(H+)降低
C.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
D.将水加热,平衡逆向移动
参考答案:C
本题解析:
本题难度:一般
4、填空题 (12分)草酸与高锰酸钾在酸性条件下能够发生如下反应:
2MnO4- + 5H2C2O4 +6H+ =2Mn2+ +10CO2↑ +8H2O
用4mL0.001mol/LKMnO4溶液与2mL0.01mol/LH2C2O4溶液,研究不同条件对化学反应速率的影响。改变的条件如下:
组别
| 10%硫酸溶液的体积/mL
| 温度/℃
| 其他物质
|
Ⅰ
| 2mL
| 20
| 无
|
Ⅱ
| 2mL
| 20
| 10滴饱和MnSO4溶液
|
Ⅲ
| 2mL
| 30
| 无
|
Ⅳ
| 1mL
| 20
| 1mL蒸馏水
(1)如果研究催化剂对化学反应速率的影响,应使用实验 和 (用Ⅰ~Ⅳ表示,下同);如果研究温度对化学反应速率的影响,应使用实验 和 。
(2)对比实验Ⅰ和Ⅳ,可以研究 对化学反应速率的影响,实验Ⅳ中加入1mL蒸馏水的目的是 。
(3)在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度。在H2SO4溶液中,反应如下:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
①用托盘天平称取W g Na2C2O4晶体。
②将WgNa2C2O4配成100 mL标准溶液,量取20.00 mL置于锥形瓶中,
酸性KMnO4溶液应装在________(填“酸式”或“碱式”)滴定管中。
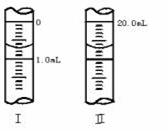
③若滴定管的起始读数和终点读数如图所示,则酸性KMnO4的物质的浓度为________ (填表达式,用W表示)。
参考答案:(1)Ⅰ、Ⅱ ;Ⅰ、Ⅲ;(2)c(H+
本题解析:
试题分析::(1)研究催化剂对反应速率的影响,需要其他条件相同;实验I和II 的实验中,Ⅱ中加硫酸锰是验证催化剂对反应速率的影响;研究温度变化需要改变温度探究反应速率变化,选择实验I和III,故答案为:I;II; I;III;(2)对比实验I和IV,硫酸体积不同,探究氢离子浓度对反应速率的影响,加入1ml水的目的是保持溶液总体积不变,改变硫酸溶液中氢离子浓度,
故答案为:c(H+)(或硫酸溶液的浓度);确保所有实验中c(KMnO4)、c(H 2C2O4)浓度不变和总体积不变.(3)酸性高锰酸钾具有氧化性,能使橡胶老化,故应放在酸式滴定管中;用去酸性高锰酸钾的体积为(20.70-0.70)ml=20.00ml,Na2C2O4的物质的量为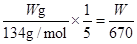 mol,根据方程式得到关系式为2MnO4-~5C2O42-, mol,根据方程式得到关系式为2MnO4-~5C2O42-,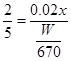 ,解得x=2W/67mol·L-1,故答案为c(H+)(或硫酸溶液的浓度)确保所有实验中c(KMnO4)、c(H2C2O4)不变和溶液总体积不变(3)②酸式 ③2W/67mol·L-1. ,解得x=2W/67mol·L-1,故答案为c(H+)(或硫酸溶液的浓度)确保所有实验中c(KMnO4)、c(H2C2O4)不变和溶液总体积不变(3)②酸式 ③2W/67mol·L-1.
考点:化学反应速率
本题难度:困难
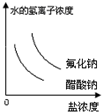
5、选择题 已知:常温下氢氟酸Ka=3.5×10-4,醋酸Ka=1.8×10-5,能正确描述在它们的钠盐溶液中,水电离出的c(H+)与盐浓度的关系曲线的是( ) A.
B.

C.
D.

参考答案:C
本题解析:
本题难度:一般
|