微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 标准状况下,用一定量的水吸收氨气后制得浓度为12.0 mol/L、密度为0.915 g/cm3的氨水。试计算1体积水吸收多少体积的氨气可制得上述氨水。(2分)
(本题中氨的式量以 17.0计,水的密度以1.00 g/cm3计)
参考答案:见解析
本题解析:(1)1.00 L该氨水中含氨的质量为12.0 mol×17.0 g/mol
其体积在标准状况下为 12.0 mol×22.4 L/mol
1.00 L该氨水中含水的质量为 1.00 L×0.915 g/L-12.0 mol×17.0 g/mol(1分)
其体积为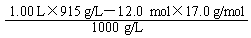
![]()
本题难度:简单
2、选择题 下列叙述中正确的是(??? )
A??? 1mol??? H2O的质量是18gmol-1????? B??? CH4的摩尔质量为16g????
C??? 3.01×1023个SO2分子的质量为32克? D???标况下1mol乙醇的体积为22.4 L
参考答案:C
本题解析:略
本题难度:简单
3、填空题 0.1molNH4+中约含有 个N,约含有 个H.
参考答案:6.02 × 1022; 2.408 × 1023
本题解析:根据化学式可知,离子中含有1该氮原子。用于 ,所以0.1molNH4+中约含有6.02 × 1022个氮原子;而氢原子是0.1mol×4×6.02 × 1023/mol=2.408 × 1023
,所以0.1molNH4+中约含有6.02 × 1022个氮原子;而氢原子是0.1mol×4×6.02 × 1023/mol=2.408 × 1023
本题难度:一般
4、选择题 设NA为阿伏加德罗常数,下列说法正确的是(??)
A.S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
B.将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积约为22.4L
C.在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,每生成4molCl2转移的电子数为8NA
D.100ml1mol/LAlCl3溶液中含的阳离子数为0.1NA
参考答案:A
本题解析:
试题分析:A. 无论是S2还是S8都是由S原子构成的。n(S)=m/M=6.4g÷32g/mol=0.2mol.所以所含硫原子数一定为0.2NA。正确。B.二者会发生反应:NH3+HCl= NH4Cl. NH4Cl是固态物质。若混合时物质的量之比为1:1,则反应后无气体。若混合时物质的量的比不是1:1.则混合后的气体体积为反应过量的气体的物质的量所具有的体积,一定小于22.4L。错误。C.在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,氯元素的化合价从KClO4中的+7→Cl2中的0价
本题难度:一般
5、选择题 下列有关环境污染说法不正确的是
A.空气质量报告有关的指标有:NO、NO2、SO2、CO2
B.工业固硫两个主要的方程式为:CaO+SO2=CaSO3,2CaSO3+O2=2CaSO4
C.在我国引起酸雨的主要因素是SO2的排放,温室效应是由CO2引起的
D.为了减少对大气臭氧层的破坏,我们应寻找氟里昂的替代产品
参考答案:A
本题解析:分析:A.空气质量报告中的污染物主要有可吸入粉尘、一氧化碳、二氧化硫、氮的氧化物等
B.工业用生石灰固硫两个主要的方程式为:CaO+SO2=CaSO3,2CaSO3+O2=2CaSO4;
C.我国是以煤为主要能源结构,所以引起酸雨的主要原因是SO2的排放;温室效应的原因是CO2的排放;
D.氟里昂能引起臭氧层的破坏;
解答:A.空气质量报告中的污染物主要有可吸入粉尘、一氧化碳、二氧化硫、氮的氧化物等,CO2无毒,不属于空气污染物,故A错误;
B.工业用生石灰固硫两个主要的方程式为:CaO+SO2=CaSO3,2CaSO3+O2=2CaSO4,故B正确;
C.我国是以煤为主要能源结构,所以引起酸雨的主要原因是SO2的排放;温室效应的原因是CO2的排放,故C正确;
D.氟里昂能引起臭氧层的破坏,所以为了减少对大气臭氧层的破坏,我们应寻找氟里昂的替代产品,故D正确;
故选:A;
点评:本题考查污染物以及危害,明确常见的环境污染物及危害即可解答,题目难度不大.
本题难度:一般