微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 水的电离平衡曲线如图所示,下列说法不正确的是??????????????????????????? ( )
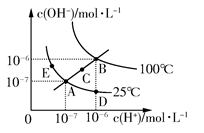
A.图中五点KW间的关系:B>C>A=D=E
B.若从A点到D点,可采用在水中加入少量酸的方法
C.若从A点到C点,可采用温度不变时在水中加入适量NH4Cl固体的方法
D.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性
参考答案:C
本题解析:水的离子积常数只与温度有关,图中A、D、E三点的KW相等,都是25℃时水的电离平衡状态;B点是100℃时水的电离平衡状态,水的电离程度最大,KW最大;C点的KW介于A点和B点之间。从A点到D点,c(OH-)减小,c(H+)增大,溶液显酸性,可以采用加入少量酸的方法。从A点到C点,c(OH-)和c(H+)都增大,且增大之后仍然有c(H+)=c(OH-),应是温度升高所致,加入NH4Cl固体后溶液显酸性,C项错误。在B点时,KW=10-12,pH=2的硫酸中,c(H+)=0.01 mol/L;pH=10的KO
本题难度:一般
2、填空题 某硫酸工厂的酸性废水中砷(As)元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,工艺流程如下:
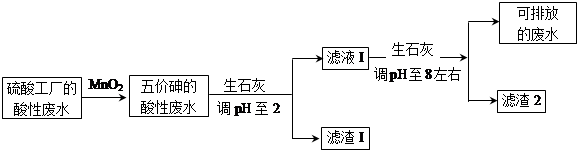
相关数据如下表,请回答以下问题:
表1.几种盐的Ksp
难溶物
| Ksp
|
Ca3(AsO4)2
| 6.8×10-19
|
CaSO4
| 9.1×10-6
|
FeAsO4
| 5.7×10-21
?
表2.工厂污染物排放浓度及允许排放标准
污染物
| H2SO4
| As
| 废水浓度
| 29.4g/L
| 1.6g·L-1
| 排放标准
| pH 6~9
| 0.5mg·L-1
?
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=???????????mol·L-1。
(2)若酸性废水中Fe3+的浓度为1.0×10-4mol·L-1,c(AsO43-)=??????????mol·L-1。
(3)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),MnO2被还原为Mn2+,反应的离子方程式为?????????????????????????????????????????????。
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为?????????????;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀,原因为???????????????????????????????
???????????????????????????????????????????????????????????????????????????。
③砷酸(H3AsO4)分步电离的平衡常数(25℃)为:K1=5.6×10-3?K2=1.7×10-7?K3=4.0×10-12,第三步电离的平衡常数的表达式为K3=???????????????????????????。Na3AsO4的第一步水解的离子方程式为:AsO43-+H2O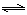 HAsO42-+OH-,该步水解的平衡常数(25℃)为:??????????????????(保留两位有效数字)。 HAsO42-+OH-,该步水解的平衡常数(25℃)为:??????????????????(保留两位有效数字)。
参考答案:(17分)
(1)0.3 (2分)
(2)5.7
本题解析:
试题分析:(1)读表2中信息,以1L废水为研究对象,其中含有29.4gH2SO4,由于硫酸的相对分子质量为98,m/M=n,则n(H2SO4)=29.4g÷98g/mol=0.3mol,由于c=n/V,则c(H2SO4)=0.3mol÷1L=0.3mol/L;(2)FeAsO4是难溶盐,废水中存在其沉淀溶解平衡:FeAsO4 (s) 本题难度:困难 本题难度:困难
3、选择题 下列热化学方程式中的△H能表示可燃物的燃烧热的是[???? ]
A.H2(g)+ Cl2(g)=2HCl(g) △H=-184KJ·mol-1
B.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-802.3J·mol-1
C.CO(g)+1/2O2(g)=CO2(g) △H=-293KJ·mol-1
D.2H2(g)+O2(g)=2H2O(l) △H=-571.6KJ·mol-1
参考答案:C
本题解析:
本题难度:一般
4、选择题 下列说法或表示方法正确的是
A.等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B.由C(石墨)=C(金刚石) 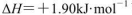 可知,金刚石比石墨稳定 可知,金刚石比石墨稳定
C.一定条件下,将0.5 mol N2(g)和1.5 molH2 (g)置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:
D.在稀溶液中,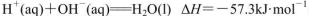 ,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ ,若将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ
参考答案:D
本题解析:
试题分析:A.等质量的硫蒸气的能量比硫固体的能量高,所以等物质的量的硫蒸气和硫固体分别完全燃烧,前者放出热量多,错误;B.石墨生成金刚石需要吸收能量,根据能量越低越稳定,石墨比金刚石稳定,错误;C.对可逆反应而言,反应物不能彻底进行,0.5 mol N2(g)和1.5 molH2 (g)置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,反应掉的氮气小于0.5mol,所以1mol氮气完全反应放热大于38.6kJ,错误;D.中和热是指强酸、强碱的稀溶液反应生成1mol水时放出的热量,浓硫酸在稀释过程中会放出大量的热,所以将含0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量大于57.3kJ,正确;选D。
考点:考查化学反应中的能量变化。
本题难度:一般
5、选择题 25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2800 kJ/mol,则下列热化学方程式正确的是 [???? ]
A.C(s)+1/2O2(g)=CO(g) △H= -393.5 kJ/mol
B.2H2(g)+O2(g)=2H2O(l) △H= +571.6 kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H= -890.3 kJ/mol
D.C6H12O6(s) +6O2(g)=6CO2(g)+6H2O(l) △H= -2800 kJ/mol
参考答案:D
本题解析:
本题难度:简单
|
|