微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 Na2C2O4能被高锰酸钾氧化生成二氧化碳。实验测知每生成1120mL(标准状况)二氧化碳需消耗100mL0.1mol/L的高锰酸钾溶液,则反应后锰元素的化合价为????????????????????
A.+6
B.+4
C.+2
D.无法确定
参考答案:C
本题解析:试图通过化学方程式去确定答案,因配平问题的复杂性只能放弃或乱猜。
正确思路:运用氧化还原反应得失电子守恒解题。设反应后锰元素

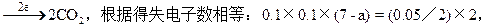 本题难度:一般
本题难度:一般
2、填空题 (1)在标准状况下,3.55g氯气的体积是______L,将其与氢气完全化合需氢气的物质的量是______mol,将生成的气体制成100mL溶液,溶质的物质的量浓度是______mol?L-1,将此溶液取出20mL加蒸馏水稀释成500mL溶液,此稀稀后的溶液中溶质的物质的量浓度是______mol?L-1.
(2)写出下列反应的化学方程式:
①镁在二氧化碳中燃烧反应:______.
②实验室用二氧化锰与浓盐酸反应制取氯气:______.
③金属铜与浓硫酸加热反应:______.
(3)白磷(P4)是一种常见的晶体,可用于制备较纯的磷酸.已知白磷和氯酸溶液可发生如下反应:
______P4+______HClO3+______=______HCl+______H3PO4
配平并完成上述反应方程式,该反应的氧化剂是______;若有1mol?P4反应,则有______mol电子转移.
参考答案:(1)n(Cl2)=
本题解析:
本题难度:一般
3、选择题 火法炼铜首先要焙烧黄铜矿,反应为:2CuFeS2+O2→Cu2S+2FeS+SO2??则下列说法正确的是
A.CuFeS2仅作还原剂,硫元素被氧化
B.每生成1mol Cu2S,有4 mol硫被氧化
C.SO2只是氧化产物,FeS只是还原产物
D.每转移1.2 mol电子,有0.2 mol硫被氧化
参考答案:D
本题解析:
试题分析:A、Cu元素由+2价降低为+1价,S元素由-2价升高到+4价,硫元素被氧化,CuFeS2既是氧化剂又是还原剂,故A错误;B、由方程式可知,每生成1mol Cu2S,有1mol硫被氧化生成SO2,其它物质中的S元素化合价没有发生变化,故B错误;C、生成FeS,元素化合价没有变化,FeS不是还原产物,也不是氧化产物,故C错误;D、元素化合价升高的只有S元素,由-2价升高到+4价,变化6价,则每转移1.2mol电子,有0.2mol硫被氧化,故D正确,答案选D。
本题难度:一般
4、填空题 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理常采用:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①浓盐酸在反应中显示出来的性质是_______(填序号)。
A.只有还原性
B.还原性和酸性
C.只有氧化性
D.氧化性和酸性
②若上述反应中产生0.1 mol ClO2,则转移电子的物质的量为_______mol。
(2)目前已开发出用电解法制取ClO2的新工艺。

①上图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。写出阳极产生ClO2的电极反应式:??????????????????????????????????????????????????????????。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为_________mol;用平衡移动原理解释阴极区pH增大的原因???????????????????????????????????????????????????????????????????????????。
(3)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果。某工厂污水中含
CN- a mg/L,现用ClO2将CN-氧化,只生成两种气体,其离子反应方程式为???????????????????????????。
参考答案:(1)①B?(1分)?② 0.1??(1分)
(2)①
本题解析:
试题分析:(1)①4HCl中2HCl转化为Cl2,表现还原性,2HCl转化为NaCl,表现酸性,故B项正确。
②NaClO3中Cl元素为+5价,ClO2中Cl元素为+4价,所以产生0.1 mol ClO2,转移电子的物质的量为0.1mol。
(2)①惰性电极电解饱和食盐水,阳极Cl?失电子生成ClO2,Cl元素由-1价升高至+4价,配平可得电极方程式:Cl- - 5e- + 2H2O = ClO2↑+ 4H+?
②阴极产生的气体体积为112 mL(标准状况),则生成H2:0.11
本题难度:一般
5、填空题 (6分)请表示出下列方程式中电子转移的方向和数目,并回答下列问题
5KI+KIO3+3H2SO4=3I2+3K2SO4+3H2O
(1)此反应中,氧化剂是??????????,还原剂与氧化剂的物质的量之比是??????????
(2)当生成1.5mol I2时转移的电子数是??????????
参考答案: 本题解析:
本题解析:
试题分析: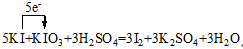
反应中元素化合价变化为:
I:-1→0???失1×5e-
I:+5→0???得5×1e-
氧化剂是KIO3、还原剂是KI,氧化剂与还原剂物质的量比为1:5。每生成3molI2转移电子数为5mol。
点评:氧化还原反应一定要分析清楚元素化合价变化。
本题难度:一般