微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:
下列说法不正确的是

A.在阴极式,发生的电极反应为:2H2O+2e- 2OH―+H2↑
2OH―+H2↑
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2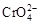 +2H+
+2H+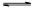
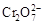 +H2O向右移动
+H2O向右移动
C.该制备过程总反应的化学方程式为:4K2CrO4+4H2O 2K2Cr2O7+4KOH+2H2↑+2O2↑
2K2Cr2O7+4KOH+2H2↑+2O2↑
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为α=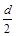
2、填空题 某化学兴趣小组用下图装置电解CuSO4溶液,测定铜的相对分子质量。

(1)若实验中测定在标准状况下放出的氧气的体积VL,A连接直流电源的__________ (填“正极”或“负极”)。
(2)电解开始一段时间后,在U形管中可观察到的现象-____________________________。
电解的离子方程式为???????????????????????????????????????????????????????????。
(3)实验中还需测定的数据是_______________(填写序号)。
①A极的质量增重m g??????②B极的质量增重m g
(4)下列实验操作中必要的是____________(填字母)。
A.称量电解前电极的质量
B.电解后,电极在烘干称重前,必须用蒸馏水冲洗
C.刮下 电解过程中电极上析出的铜,并清洗、称重
D.电极在烘干称重的操作中必须按“烘干—称重一再烘干一再称重”进行
E.在有空气存在的情况下,烘干电极必须采用低温烘干的方法
(5)铜的相对原子质量为:_______________________(用含有m、V的计算式表示)。
(6)如果用碱性(KOH为电解质)甲醇燃料电池作为电源进行实验,放电时负极的电极反应式为???????????????????????????????????????????????????????????。
3、选择题 高铁酸盐在能源、环境保护等有着广泛的用途,可以用电解法制高铁酸盐(已知高铁酸盐在酸眭条件下不稳定),总反应式为:Fe+2H2O+20H- 3H2↑+FeO42-。下列说法正确的是
3H2↑+FeO42-。下列说法正确的是
A.铁为阳极,H2SO4为电解液
B.铁为阴极,浓NaOH为电解液
C.阳极发生的电极反应为:Fe+80H--6e-=====4H20+Fe042-
D.铁失去3mol电子可以在阴极得到33.6L氢气
4、选择题 用铂电极电解100mL HNO3与 AgNO3的混合液,通电一段时间后,两极均收集到2.24 L 气体(标准状况),则原混合液中Ag+的物质的量浓度为 (????????????? )
A.1mol/L
B.2mol/L
C.2.5mol/L
D.3mol/L
5、填空题 (10分)某同学用碳棒、纯铜片、直流电源和稀硫酸为原材料,实现了在通常条件下不能发生的反应:Cu + H2SO4(稀) = CuSO4 + H2↑
(1)请在右边方框中画出能够实现这一反应的装置图。

(2)在设计实验实际操作时,由于装置连接不当,他看到了完全不同的实验现象:碳棒和铜片上均有无色气泡产生,溶液并未变为蓝色。请你分析其原因????????①?????????。
假设按照该方案进行实验,且收集到碳棒上产生气体体积为11. 2L(标准状况下)。则该过程中铜片上发生的反应式为?????②???。此时要使溶液恢复到实验前的状态,需加入????③?????(写出该物质的化学式),其质量为???? ④????。