微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)常温下将0.2 mol/L HCl溶液与0.2 mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
(1)①混合溶液中由水电离出的c(H+)________HCl溶液中由水电离出的c(H+)。(填“>”、“<”或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-)-c(M+)=__________mol/L;c(H+)-c(MOH)=________mol/L。
(2)常温下若将0.2 mol/L MOH溶液与0.1 mol/L HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度______MCl的水解程度。(填“>”、“<”或“=”)
参考答案:(1)①>;②9.9×10-7;10-8;(2)<
本题解析:略
本题难度:困难
2、选择题 在Na2S溶液中c(Na+)与c(S2-)的比值是
A.2
B.小于2
C.大于2
D.1/2
参考答案:C
本题解析:
试题分析:
若S2-不水解,则c(Na+)与c(S2-)的比值等于2。但在实际Na2S溶液中,S2-容易水解(分步水解): S2-+H2O HS- +OH-,HS-+ H2O
HS- +OH-,HS-+ H2O H2S+OH- ,所以c(Na+)与c(S2-)的比值大于2。
H2S+OH- ,所以c(Na+)与c(S2-)的比值大于2。
考点:考查盐类的水解
点评:本题考查了盐类的水解,离子浓度大小的比较,难度不大。解题时注意S2-水解,导致c(S2-)比c(Na+)的1/2还要小。
本题难度:一般
3、选择题 下列关于电解质溶液中离子关系的说法正确的是:
A.新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-)
B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
C.0.2mol·L-1 CH3COOH溶液与0.1mol·L-1 NaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
D.pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+)
参考答案:C
本题解析:
试题分析:根据电荷守恒,c(Na+) +c(H+)=c(Cl-)+c(ClO-)+c(OH-),故A错误;HCO3—既能电离生成CO32-,又能水解生成H2CO3,pH=8.3说明水解程度大于电离,所以c(CO32-)<c(H2CO3),故B错误;0.2mol·L-1 CH3COOH溶液与0.1mol·L-1 NaOH溶液等体积混合,根据电荷守恒,c(CH3COO-)+ c(OH-)= c(Na+)+ c(H+);根据物料守恒,c(CH3COO-)+c(CH3COOH)="2" c(Na+),综合以上2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH),故C正确;pH=11的氨水与pH=3的盐酸等体积混合,氨水剩余,溶液呈碱性,故D错误。
考点:本题考查离子浓度大小比较。
本题难度:困难
4、填空题 (14分)某工业原料主要成分是NH4Cl、FeCl3和AlCl3。利用此原料可以得到多种工业产品。分析下面流程,回答问题。
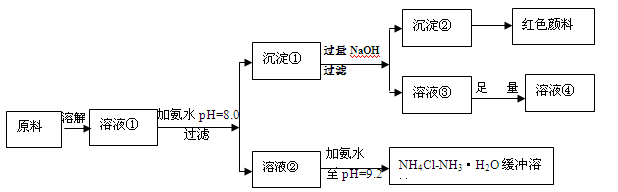
已知:Ksp[Fe(OH)3]=4.0×10-38
(1)用稀硫酸中和等体积等pH值的氨水和烧碱溶液,前者需要消耗的酸液体积 (填“大”“小”或“相同”)
(2)计算溶液②中Fe3+的物质的量浓度为 mol/L
(3)缓冲溶液中存在的平衡体系有: 、 、
此时溶液中c(NH4+) c(Cl-)(填>、=、<)。
(4)在缓冲溶液中加入少量盐酸或者NaOH溶液,溶液的pH值几乎依然为9.2。简述原理:
请举出另一种缓冲溶液的例子(写化学式) 。
(5)常温下向较浓的溶液④中不断通入HCl气体,可析出大量AlCl3·6H2O晶体,结合化学平衡移动原理解释析出晶体的原因: 。
参考答案:(1)大 &#
本题解析:
试题分析:(1)pH相同的氨水和烧碱,氨水的物质的量浓度大,所以需要的酸的体积大。(2) 溶液的pH=8,氢离子浓度=10-8mol/L,氢氧根离子浓度=10-6mol/L,根据Ksp[Fe(OH)3]=4.0×10-38计算铁离子浓度=4.0×10-20。
(3)缓冲溶液中有铵根离子,所以存在铵根离子的水解平衡,NH4++H2O NH3·H2O+H+,溶液中有一水合氨,NH3·H2O
NH3·H2O+H+,溶液中有一水合氨,NH3·H2O NH4++OH-,存在一水合氨的电离平衡,溶液中肯定存在水的电离平衡, H2O
NH4++OH-,存在一水合氨的电离平衡,溶液中肯定存在水的电离平衡, H2O H++OH-。由于溶液中的pH=9.2,所以溶液显碱性,说明氢离子浓度小于氢氧根离子浓度,根据电荷守恒,所以铵根离子浓度大于氯离子浓度。(4)缓冲溶液中加入少量盐酸,平衡体系(Ⅱ)产生的OH-与酸反应,消耗了加入的H+,当加入少量碱时,平衡体系(Ⅰ)的NH4+与碱反应,消耗了加入的OH-,从而可在一定范围内维持溶液pH大致不变。类似的缓冲溶液由CH3COONa-CH3COOH。 (5) 沉淀①为氢氧化铝和氢氧化铁,加入过量氢氧化钠后溶液③为偏铝酸钠,沉淀②为氢氧化铁沉淀,溶液③中加入足量的盐酸,得到的溶液④为氯化铝溶液,在AlCl3饱和溶液中存在溶解平衡:AlCl3·6H2O(s)
H++OH-。由于溶液中的pH=9.2,所以溶液显碱性,说明氢离子浓度小于氢氧根离子浓度,根据电荷守恒,所以铵根离子浓度大于氯离子浓度。(4)缓冲溶液中加入少量盐酸,平衡体系(Ⅱ)产生的OH-与酸反应,消耗了加入的H+,当加入少量碱时,平衡体系(Ⅰ)的NH4+与碱反应,消耗了加入的OH-,从而可在一定范围内维持溶液pH大致不变。类似的缓冲溶液由CH3COONa-CH3COOH。 (5) 沉淀①为氢氧化铝和氢氧化铁,加入过量氢氧化钠后溶液③为偏铝酸钠,沉淀②为氢氧化铁沉淀,溶液③中加入足量的盐酸,得到的溶液④为氯化铝溶液,在AlCl3饱和溶液中存在溶解平衡:AlCl3·6H2O(s) Al3+(aq) +3Cl—(aq) +6H2O(l),通入HCl气体使溶液中c(Cl—)增大,平衡向析出固体的方向移动从而析出AlCl3晶体。
Al3+(aq) +3Cl—(aq) +6H2O(l),通入HCl气体使溶液中c(Cl—)增大,平衡向析出固体的方向移动从而析出AlCl3晶体。
考点:盐类的水解。
本题难度:困难
5、填空题 下列一句话中叙述了两个值,前者记为M,后者记为N,M和N的关系从A、B、C、D 中选择:
A.M>N B.M<N C. M="N" D. 无法比较
(1)相同温度下,1L 1mol/L 的NH4Cl溶液和2 L 0.5mol·L-1NH4Cl溶液,两溶液中NH4+的个数: ;
(2)相同温度下,pH值为12的烧碱溶液和CH3COONa溶液,两溶液中水的电离程度: ;
(3)常温下两份等浓度的纯碱溶液,将第二份升高温度,两溶液中c(HCO3-): ;
(4)将pH值为2的醋酸和盐酸都稀释相同倍数所得稀溶液的pH值: ;
参考答案:(1)A (2)B (3)B
本题解析:
试题分析:(1)氯化铵中,铵根离子水解,铵根离子浓度越大水解程度越小,即相同温度下,1L 1mol/L 的NH4Cl溶液中的NH4+个数大于2L 0.5mol?L-1NH4Cl溶液中NH4+的个数,故答案为:A;(2)pH值为12的烧碱溶液中水电离出的氢离子浓度为10-12mol/L,pH值为12的CH3COONa溶液中水电离出的氢离子浓度为10-2mool/L,所以相同温度下,pH值为12的烧碱溶液中水的电离度小于pH值为12的CH3COONa溶液中水的电离度,故答案为:B;(3)碳酸钠溶液中,碳酸根的水解程度随着温度的升高而增大,及升高温度以黄埔,碳酸氢根的浓度增大,故答案为:B;(4)醋酸是弱酸,稀释促进电离,盐酸是强酸,稀释过程浓度减小,所以将pH值为2的醋酸和盐酸都稀释相同倍数所得稀溶液的pH值是醋酸的小于盐酸的,故答案为:B;
考点:影响盐类水解程度的主要因素;有关ph的计算
本题难度:一般