微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (15分)铜及其化合物与生产、生活关系密切。
(1)用新制Cu(OH)2与葡萄糖反应制备Cu2O,该反应中葡萄糖是 (填“氧化剂”或“还原剂”)
(2)用H2O2稀硫酸共同浸泡废印刷电路板可制备CuSO4若将该反应设计成原电池,
正极的电极反应式为
(3)用NH4NO3氧化海绵铜(含Cu和CuO)生产CuCl的部分流程如下:
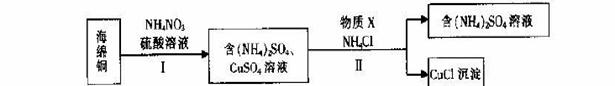
①步骤I中,反应温度不宜过高的原因是 。
②步骤I中,0.5 mol NH4NO3参加反应有4mol电子转移,铜参与反应的离子方程式为 。
③步骤II中,物质X可选用的物质是 。(填序号)。
a.Cu b.C12 c.H2O2 d.(NH4)2SO3
④步骤II中物质X需要过量的原因,其一是加快反应速率,其二是 _。
⑤步骤II中当NH4 Cl加到一定的量时,生成CuCl 会部分溶解生成CuCl2-在一定温度下建立两个平衡:
Cu Cl(s) 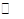 Cu+(a q) + Cl-(a q) Ksp=1.4x10-6
Cu+(a q) + Cl-(a q) Ksp=1.4x10-6
Cu Cl(s) + Cl一(a q)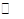 CuCl2(a q) K=0.35
CuCl2(a q) K=0.35
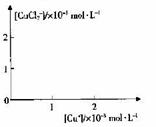
分析[Cu+]、[CuCl2-]和Ksp,K的数学关系,在图中画出「Cu+]、[CuCl2]-的关系曲线(要求至少标出坐标点)
参考答案:(1)还原剂
本题解析:
试题分析:(1)用新制Cu(OH)2与葡萄糖反应制备Cu2O,铜元素由+2价得电子生成+1价的Cu2O,作氧化剂,该反应中葡萄糖是还原剂。
(2)用H2O2稀硫酸共同浸泡废印刷电路板可制备CuSO4,若将该反应设计成原电池,铜失电子做负极,正极是H2O2得电子生成水,则正极的电极反应式为H2O2+2e-+2H+=2H2O。
(3)①硝酸铵受热分解生成氮氧化物,所以步骤I中,反应温度不宜过高的原因是防止产生氮氧化物造成污染,②用NH4NO3氧化海绵铜,铜失电子,NO3-得电子,0.5 mol NH4NO3参加反应有4mol电子转移,说明1molNO3-得8mol电子,氮元素由+5价降低到—3价,所以铜参与反应的离子方程式为4Cu+NO3-+10H+=4Cu2++NH4++3H2O,③步骤II是将硫酸铜还原成CuCl,铜元素由+2价降低到+1价,做氧化剂,需加入具有还原性的物质,且不引入杂质,a. Cu 和d. (NH4)2SO3具有还原性,能达到要求,b. C12和c. H2O2都具有强氧化性,不符,所以物质X可选用的物质是ad,④CuCl很不稳定,容易被氧化,步骤II中物质X需要过量的原因,其一是加快反应速率,其二是防止CuCl被氧化,
⑤根据①Cu Cl(s) 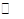 Cu+(a q) + Cl-(a q) Ksp=1.4x10-6, ② Cu Cl(s) + Cl一(a q)
Cu+(a q) + Cl-(a q) Ksp=1.4x10-6, ② Cu Cl(s) + Cl一(a q)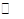 [CuCl2]-1(a q) K=0.35 ,①+②得2Cu Cl(s)
[CuCl2]-1(a q) K=0.35 ,①+②得2Cu Cl(s) 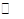 Cu+(a q)+ [CuCl2]-(a q) K=0.49×10-6,根据方程式可知:c(Cu+)·c([CuCl2]-)=0.49×10-6,两离子浓度成反比,两离子浓度相同时为0.7×10-3mol/L,据此可画出图像为:
Cu+(a q)+ [CuCl2]-(a q) K=0.49×10-6,根据方程式可知:c(Cu+)·c([CuCl2]-)=0.49×10-6,两离子浓度成反比,两离子浓度相同时为0.7×10-3mol/L,据此可画出图像为:
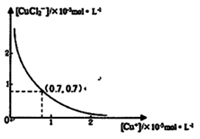
考点:考查葡萄糖的化学性质,用NH4NO3氧化海绵铜(含Cu和CuO)生产CuCl的工艺流程,化学图像的绘制。
本题难度:困难
2、计算题 (10分)温室下取0.2mol/L的盐酸与0.2mol/LMOH等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答下列问题
(1)混合溶液中由水电离出的c(H+)_______0.2mol/L盐酸中水电离出的c(H+)(填“<”、“>”、“=”)。
(2)求出混合溶液中下列算式的精确计算结果(填具体数字,忽略混合后溶液体积的变化),c(Cl—)-c(M+)=_____________mol/L,c(H+)-c(MOH)="_______________" mol/L
(3)室温下如果取0.2mol/LMOH溶液与0.1mol/L盐酸等体积混合,测得混合溶液的pH<7,则说明MOH的电离程度________MCl的水解程度(填“<”、“>”、“=”),溶液中各离子浓度由大到小的顺序为_____________________________
参考答案:(1)> (2)9.9×10—7、1×10—8?(3)
本题解析:(1)M+能水解,它促进了水的电离;在MCl中c(OH-)=10—8mol/L,(2)由电荷守恒原理有c(H+)+c(M+)=c(OH-)+c(Cl—),c(Cl—)-c(M+)=c(H+)-c(OH-)=9.9×10—7;再由质子守恒得c(H+)=c(MOH)+c(OH-),c(H+)-c(MOH)=c(OH-)=1×10—8。(3)混合后得到的是物质的量浓度相等的MCl、MOH,前者M+水解使溶液呈酸性,后者能电离出OH-使溶液呈碱性,因溶液的pH<7,说明M+的水解程度大于MOH的电离程度,故
本题难度:简单
3、选择题 在溶液中有浓度均为0.01 mol·L-1的 Fe3+ 、Cr3+ 、Zn2+ 、Mg2+等离子,已知:Ksp[Fe(OH)3]=2.6×10-39 mol4·L-4;Ksp[Cr(OH)3]=7.0×10-31 mol4·L-4; Ksp[Zn(OH)2]=1.0×10-17 mol3·L-3;Ksp[Mg(OH)2]=1.8×10-11 mol3·L-3 当氢氧化物开始沉淀时,下列哪一种离子所需溶液的pH最小?
[???? ]
A.Fe3+
B.Cr3+
C.Zn2+
D.Mg2+
参考答案:A
本题解析:
本题难度:一般
4、选择题 已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑
(2)CuSO4+Na2S: Cu2++S2-=CuS↓
下列几种物质的溶解度大小的比较中,正确的是
A.CuS<Cu(OH)2<CuCO3
B.CuCO3<Cu(OH)2<CuS
C.CuS<CuCO3<Cu(OH)2
D.Cu(OH)2<CuCO3<CuS
参考答案:A
本题解析:
试题分析:化学反应的过程总是由溶解度大的转化为溶解度小的。从第一个反应式中可以得出的结论是:溶解度:Cu(OH)2<CuCO3;由第二个程式可以得出的结论是:CuS<Cu(OH)2;因为在第二个反应中,溶液中既有硫离子,也有水,只所以生成硫化铜,而没生居氢氧化铜,就是因为硫化铜的溶解度比氢氧化铜的溶解度小,因此选A。
本题难度:简单
5、实验题 类比是一种重要的科学研究方法。某化学实验小组类比AgOH能溶于氨水的性质,猜测Cu(OH)2也具有同样的性质,并对此进行实验探究:
(1)写出AgOH与氨水反应的离子方程式_____________________________________。
(2)甲组同学进行如下操作:向干燥洁净的试管中加入CuSO4溶液,再向其中逐滴加入氨水,观察到蓝色沉淀生成;继续滴加,观察现象,由此得出Cu(OH)2可溶于氨水的结论。
①写出生成蓝色沉淀的离子方程式:_______________________________________________
②写出向沉淀中滴加氨水的实验现象:______________________________________________
(3)乙组同学向CuSO4溶液中滴加NaOH溶液,制得Cu(OH)2悬浊液A,向其中加入足量氨水,始终未观察到(2)中的现象。甲乙两组同学在对他们的实验及现象进行比对后,决定对Cu(OH)2与氨水反应的机理进行探究:
①该实验小组的同学取一定量上述制得的Cu(OH)2悬浊液A,向其中加入足量饱和NH4Cl溶液,结果观察到(2)中现象。据此,有同学认为由于饱和NH4Cl溶液的加入引入了Cl—,致使Cu(OH)2与氨水的反应得以发生,而指导老师表示这一观点是不成立的。为了排除Cl—的干扰,该组同学又做了如下实验:取一定量上述制得的Cu(OH)2悬浊液A,向其中加入饱和___________溶液(填化学式),结果同样观察到(2)中的现象,据此可知该反应的发生与Cl—无关。
②因此,同学们又提出:Cu(OH)2与氨水的反应的发生需要NH4+的参与,于是同学们进一步探究:向干燥洁净的试管中加入CuSO4溶液,再向其中逐滴加入氨水,观察到蓝色沉淀生成。通过离心的方法得到Cu(OH)2沉淀。将沉淀洗涤后,置于干燥洁净的试管中,向试管中滴加足量饱和氨水,为观察到(2)中现象,再向试管中滴加足量饱和NH4Cl溶液,观察到(2)中现象。
(i)检验是否沉淀洗涤干净的操作是___________________________________________
(ii)据此,可以得出结论:在Cu(OH)2与氨水的反应中,NH4+起着至关重要的作用,且________________对反应的发生有影响。
(4)试从溶解平衡角度解释上述反应发生过程中NH4+的作用:___________________________。
参考答案:
(1)AgOH+2NH3·H2O=Ag(NH3)2+
本题解析:
试题分析:(1)向AgOH中滴加氨水会生成银氨络合离子。
(2)①蓝色沉淀为氢氧化铜。②蓝色沉淀逐渐溶解,因此生成的铜氨络合离子。
(3)①为排除其他离子的干扰,可加入(NH4)2SO4。
②(i)该沉淀中可能含有的杂质离子是硫酸根,因此检验硫酸根即可。
(ii)从实验操作看,用的是饱和溶液,因此NH4+的浓度对反应也有影响。
(4)实验过程中存在的平衡有:Cu(OH)2 本题难度:一般
本题难度:一般