微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在25℃时,AgX、AgY、AgZ均难溶于水,且Ksp(AgX) =1.8×10-10,Ksp(AgY)= 1.0×10-12,
Ksp(AgZ)=8.7×10-17。下列说法(均在25℃)错误的是[???? ]
A.三种饱和溶液中溶质的物质的量浓度的大小顺序为c(AgX)>c(AgY)>c( AgZ)
B.若向AgY的饱和溶液中加入少量的AgX固体,则c(Y-)减少
C.若取0. 188 g AgY(相对分子质量188)固体放入100 mL水中(忽略溶液体积的变化),则溶液中Y的物质的量浓度为1.0×10-12 mol/L
D.往C选项的溶液中加入1 ml.0.1 mol/L的NaZ溶液,能生成AgZ沉淀
参考答案:C
本题解析:
本题难度:一般
2、选择题 下列说法正确的是[???? ]
A.?金属Cu与人体分泌的盐酸及体内的空气可反应生成一种弱酸超氧酸HO2,反应方程式如下:Cu+HCl+O2==CuCl+HO2,则有3.2gCu参加反应时有0.1NA电子发生转移
B.?用铁作电极电解饱和食盐水:2Cl-?+?2H2O Cl2↑+?H2↑+?2OH-
Cl2↑+?H2↑+?2OH-
C.常温下,向饱和?溶液中加少量粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下Ksp(BaCO3)<?Ksp(BaSO4)?
D.已知 且晶体硅在氧气中燃烧的热化学方程式是Si(s)+O2(g)==SiO2(s)?△H=-989.2KJ/mol 则可得出x=460
且晶体硅在氧气中燃烧的热化学方程式是Si(s)+O2(g)==SiO2(s)?△H=-989.2KJ/mol 则可得出x=460
参考答案:D
本题解析:
本题难度:一般
3、填空题 将含镁、钾的盐湖水蒸发,最后得到的产物中含光卤石(xKCl·yMgCl2·zH2O)。它在空气中极易潮解,易溶于水,是制造钾肥和提取金属镁的重要原料,其组成可通过下列实验测定。
①准确称取5.550 g样品溶于水,配成100 mL溶液。
②将溶液分成二等份,在一份中加入足量的NaOH溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.580 g。
③在另一份溶液中加入足量的硝酸酸化的AgNO3溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体4.305 g。
(1)步骤②中检验白色固体已洗净的方法是 。
(2)已知某温度下Mg(OH)2的Ksp = 6.4×10-12,当溶液中c(Mg2+)≤1.0×10-5 mol·L-1可视为沉淀完全,则应保持溶液的OH-的浓度≥ mol·L-1。
(3)通过计算确定样品的组成(写出计算过程)。
参考答案:(1)取最后一次洗涤液少许,滴加硝酸酸化的硝酸银溶液,若不产
本题解析:
试题分析:将向含光卤石(xKCl·yMgCl2·zH2O)的水溶液中加入过量的NaOH溶液,会发生离子反应:Mg2++2OH-=Mg(OH)2↓,而K+、Na+、Cl-则留在滤液中。在步骤②中若要检验白色固体已洗净,只要证明在滤液中无Cl-即可。方法是取最后一次洗涤液少许,滴加硝酸酸化的硝酸银溶液,若不产生沉淀,则已经洗涤干净;(2)在某温度下Mg(OH)2的Ksp = 6.4×10-12,即c(Mg2+)·c2(OH-)≥6.4×10-12,当溶液中c(Mg2+)≤1.0×10-5 mol·L-1可视为沉淀完全,则应保持溶液的OH-的浓度c2(OH-)≥6.4×10-12÷1.0×10-5 mol·L=6.4×10-7mol/L; c(OH-)≥8×10-4mol/L; (3)在5.550g样品中含有n(Mg2+)=n(Mg(OH)2)="(0.580g÷58" g/mol)×2=0.0200mol;n(MgCl2)= 0.0200mol;n(Cl-)=" (4.305g÷143." 5g/mol)×2=0.0600mol;n(KCl)= n(AgCl)=0.0600mol-2×0.0200mol=0.0200mol;n(H2O)= (5.550g-0.0200mol×95g/mol-0.0200mol×74.5g/mol)÷18g/mol=0.120mol.样品中n(KCl)n(MgCl2):n(H2O)=1:1 6。所以光卤石的化学式是KCl·MgCl2·6H2O.
考点:考查沉淀 的洗涤、溶度积常数的应用、守恒法在确定物质化学式的应用的知识。
本题难度:一般
4、填空题 (12分)
CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图:

已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物
| Fe(OH)3
| Fe(OH)2
| Co(OH)2
| Al(OH)3
|
开始沉淀
| 2.3
| 7.5
| 7.6
| 3.4
|
完全沉淀
| 4.1
| 9.7
| 9.2
| 5.2
请回答下列问题:
(1)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为   。 。
(2)加入碳酸钠调节pH至a,a的范围是 ;
(3)操作Ⅰ包含3个基本实验操作,它们是 、 和过滤。
(4)制得的CoCl2·6H2O需减压烘干的原因是 。
(5)为测定产品中CoCl2·6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量。通过计算发现产品中CoCl2·6H2O的质量分数大于100%,其原因可能是 (任写1点)。
参考答案:(12分)
(1)减少有毒气体的排放,防止大气污染;防
本题解析:略
本题难度:困难
5、填空题 复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1 mol·L-1的下列6种溶液的pH值

复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3==2CH3COONa+CO2↑+H2O 若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是
___________(填编号)。
A.CO2+H2O +2NaClO = Na2CO3+2HClO
B.CO2+H2O +NaClO = NaHCO3+HClO
C.CO2 +H2O +C6H5ONa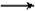 NaHCO3+C6H5OH NaHCO3+C6H5OH
D.CO2 +H2O +2C6H5ONa Na2CO3+2C6H5OH Na2CO3+2C6H5OH
E.Na2CO3+C6H5OH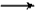 NaHCO3+C6H5ONa NaHCO3+C6H5ONa
F.CH3COOH+NaCN = CH3COONa+HCN
(2)根据前述信息判断,常温下,浓度均为0.05 mol·L-1的下列5种物质的溶液中,pH最小的是______
(填编号),其pH值为_______(填数值);pH最大的是_______(填编号)。
①HCN ②CH3COOH ③HClO4 ④HClO ⑤H2SO4
(3)一些复分解反应的发生还遵循其它的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体请根据上述反应,总结出复分解反应发生的另一规律:____________________________。
(4)根据(3)中结论,现将KI溶液和AgCl固体混合搅拌,则可能会观察到的现象是______________,反应的离子方程式为_____________________。
参考答案:(1)AD
(2)⑤;1;①
(3)复分解反应
本题解析:
本题难度:一般
|