微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 氯化铜是一种广泛用于生产颜料、用木材防腐剂的化工产品。某研究性学习小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体。
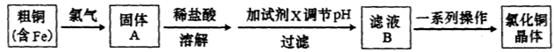
(1)固体A用稀盐酸溶解而不用水溶解的原因是________。
(2)加试剂X用于调节pH以除去杂质,X可选用下列试剂中的____(填序号)。
A.NaOH
B.NH3.H2O
C.CuO
D.Cu(OH)2E. CuSO4
(3)滤液B经一系列操作可得氯化铜晶体,操作的程序依次为_________ 、_________、 过滤、自然干燥。
(4)实验室采用如下图所示装置,可使粗铜与Cl2反应转化为固体A(部分加热仪器和夹持装置已略去)。
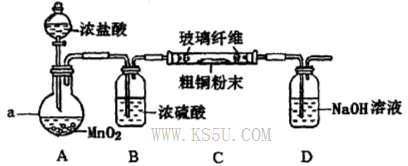
①该装置中仪器a的名称是____,其中发生反应的离子方程式是____________。
②有同学认为应在浓硫酸洗气瓶前增加吸收HCI的装置,你认为是否必要?____________(填“是”或“否”)。
③该装置存在一定的安全隐患,消除该安全隐患的措施是_______________________。
参考答案:(1)抑制Cu2+、Fe3+等离子发生水解反应????(2)
本题解析:
试题分析:(1)粗铜中含有Cu、Fe,与氯气反应时此时CuCl2、FeCl3,由于二者都是强酸弱碱盐,容易发生水解反应产生Cu(OH)2、Fe(OH)3。为了抑制Cu2+、Fe3+等离子发生水解反应通常用稀盐酸来溶解。
(2)加试剂X用于调节pH以除去杂质,,但不能引入新的杂质离子。根据题目给定的物质,可选用CuO、Cu(OH)2。选项为CD
(3)将除去Fe(OH)3沉淀的含有CuCl2滤液经一系列操作可得氯化铜晶体。CuCl2是强酸弱碱盐,水解产生Cu(OH)2和HCl。盐酸有挥发
本题难度:一般
2、填空题 铁黄是一种重要的颜料,化学式为Fe2O3·xH2 O,广泛用于涂料、橡胶、塑料、文教用品等工业。实验室模拟工业利用硫酸渣(含FeZ 0。及少量的CaO, Mg0等)和黄铁矿粉
(主要成分为FeS2)制备铁黄的流程如下:
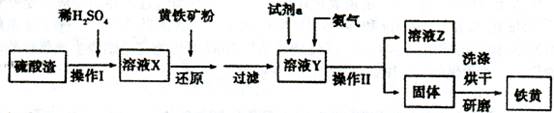
(1)操作I与操作II中都用到玻璃棒,玻璃棒在两种操作中的作用分别是_?????、??????
(2)试剂a最好选用_???(供选择使用的有:铝粉、空气、浓HNO3 );其作用是_???????????。
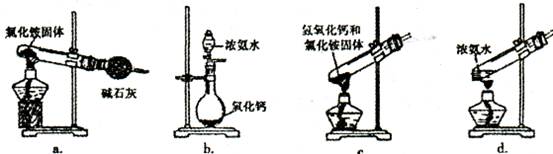
(3)上述步骤中需用到氨气。下列装置可用于实验室制氨气的是_???????_(填序号)。
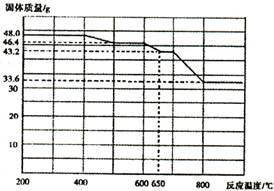
(4)查阅资料知,在不同温度下Fe2 O3被CO还原,产物可能为Fe3 O4?、FeO或Fe,固体质量与反应温度的关系如右图所示。根据图象推断670℃时Fe2 O3还原产物的化学式为M,并设计一个简单的实验,证明该还原产物的成分(依次填写每步操作中所加试剂的化学式、现象和结论)。仪器自选。可供选择的试剂:稀H2SO4、稀盐酸、H2 O2溶液、NaOH溶液、KSCN溶液。
加入试剂
| 现象
| 结论
|
?
| ?
| 则还原产物为?????
|
?
| ?
|
?
| ?
?
参考答案:
(1)搅拌加速溶液;引流。(2)空气;作氧化剂,将二
本题解析:
试题分析:(1)操作I是搅拌加速溶液溶解,操作II是过滤操作,主要用到玻璃棒引流。(2)试剂a最好选用空气,来源廉价,其作用是作氧化剂,将二价铁离子氧化为三价铁离子。(3)实验室制氨气的主要是操作简单,制作方便,由于氨气易溶于水,故要加热,可选择bd。(4)对于二价铁离子有无可用KSCN溶液不显红色判断,对于有无固体铁可用加入酸有无气泡做出判断。CO还原氧化铁的还原产物为可能Fe3O4,FeO和Fe,Fe2O3加热温度可达到500℃~600℃,质量由46.4g减少为45g,还原产物为Fe3O4;6
本题难度:困难
3、选择题 (化学-有机化学基础)下图中X是一种具有水果香味的合成香料,A是有直链有机物,E能与溴水反应产生白色沉淀。
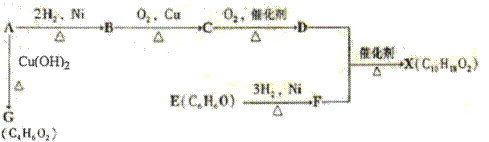
请根据上述信息回答:
(1)A中含氧官能团的名称是????,A→G的反应类型为???????。
(2)H与J互为同分异构体,J在酸性条件下水解有乙酸生成,J的结构简式为?????。
(3)D和F反应生成X的化学方程式为?????????????,B到C化学反应方程式????????????????
????????????????????????????
参考答案:(1)醛基??氧化反应
(2)CH3COOCH=CH2
本题解析:略
本题难度:一般
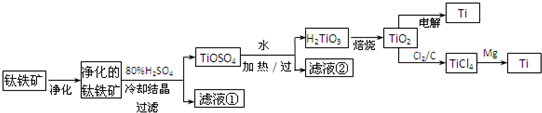
4、填空题 钛是一种重要的金属,工业上用钛铁矿(FeTiO3,含FeO、Al2O3、SiO2等杂质)为原料制钛白粉(TiO2),TiO2常通过两种方法还原可制得Ti.
其中,2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O.回答下列问题.
(1)净化钛矿石时,需用浓氢氧化钠溶液来处理,该过程中发生反应的化学方程式有:
SiO2+2NaOH=Na2SiO3+H2O和______.
(2)滤液①中的溶质主要是FeSO4,检验其中Fe2+的方法是:
______.
(3)从TiOSO4→H2TiO3需要加热,则加热的目的是______.
(4)电解TiO2来获得Ti是以TiO2作阴极,石墨为阳极,熔融CaO为电解液,用碳块作电解槽池.其阴极反应的电极反应式为______.
(5)因为TiO2?(s)+2Cl2?(g)

TiCl4(l)+O2?(g);△H=+151kJ/mol反应难于发生,所以工业上不能直接由TiO2和Cl2反应来制取TiCl4.当反应体系中加入碳后,反应分如下两步进行(如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热相同).
2C(s)+O2(g)=2CO?(g);△H=-221kJ/mol.
TiO2(s)+2C?(s)+2Cl2?(g)?

?TiCl4?(l)+2CO?(g);△H=______.
(6)从化学平衡的角度解释:往TiO2和Cl2反应体系中加入碳后,能使反应TiO2?(s)+2Cl2?(g)

TiCl4(l)+O2?(g)顺利进行的原因是______.
参考答案:(1)钛铁矿含FeO、Al2O3、SiO2等杂质,能与碱反应
本题解析:
本题难度:一般
5、实验题 黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量SiO2),为了测定该黄铜矿的纯度,某同学设计了如下实验:
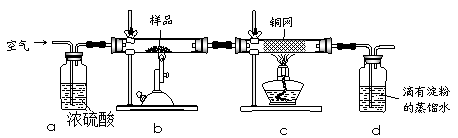 ? ?
现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的1/10置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00mL。请回答下列问题:
(1)称量样品所用的仪器为????????(填“托盘天平”或“电子天平”),将样品研细后再反应,其目的是?????????。
(2)装置a和c的作用分别是????和????(填标号)。
a.除去SO2气体
b.除去空气中的水蒸气
c.有利于气体混合
d.有利于观察空气流速
e.除去反应后多余的氧气
(3)上述反应结束后,仍需通一段时间的空气,其目的是?????。
(4)通过计算可知,该黄铜矿的纯度为??????。
(5)若用右图装置替代上述实验装置d,同样可以达到实验目的的是?????(填序号)。
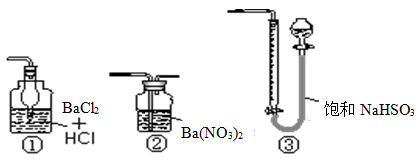
(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度误差为+1%,假设实验操作均正确,可能的原因主要有??????????。
参考答案:(1)电子天平,使原料充分反应、加快反应速率。
(2)
本题解析:(1)托盘天平的精确度为 0.1g,故只有电子天平才能称取1.150g样品;研细的目的是增大固体的表面积,使原料充分反应、加快反应速率;
(2)浓硫酸能除去空气中的水蒸气,且洗气瓶有利于观察空气流速;灼热铜网的目的是除去反应后多余的氧气;
(3)反应结束后,装置中还有SO2,所以仍需通入一段时间的空气,其目的是使反应生成的SO2全部进入d装置中,使结果精确;
(4)由c?V可知n(I2)=0.05mol/L×20.00×10-3L,由I2+SO2+2H2O=4H++2I-+SO42-可知
本题难度:一般
|