微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 把足量的铁粉投入到溶解有硫酸和硫酸铜的溶液中,充分反应后,剩余金属粉末的质量与原加入铁粉的质量相等,则原溶液中H+与SO42-的物质的量浓度之比为
A.1:4
B.2:7
C.1:2
D.3:8
参考答案:A
本题解析:掌握“差量法”的运用
铁粉发生的反应为(设硫酸铜、硫酸分别为xmol、ymol):
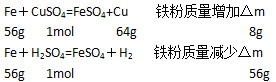
依题意可知:8x=56y,即x:y=7:1
则可计算出原溶液中H+与SO42-的物质的量浓度之比为:2×1:(7+1)=1:4
答案为A
本题难度:一般
2、填空题 活性Fe3O4为黑色固体,有磁性,其不溶于水、碱和酒精、乙醚等有机溶剂中, Fe3O4在潮湿的空气中或高温下易被O2氧化。工业上利用锈蚀废铁为原料,利用共沉淀法制备活性Fe3O4(或写为FeO·Fe2O3)的流程如下:
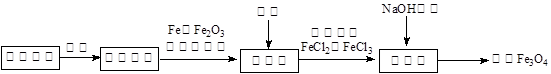
(1)在制备过程中将块状固体原料粉碎磨成粉末,作用是?????????????????????。
(2)设计合理的实验方案证明Fe3O4与盐酸反应的产物中含有Fe2+、Fe3+,简述实验操作步骤和实验现象?????????????????????????????????????????????????????????????。
(可供选择的试剂:KSCN溶液、还原铁粉、氯水、酸性高锰酸钾溶液)
(3)假如在反应池中几乎没有气体产生,在合成池里所有铁元素转化为Fe3O4,则根据相关反应可知,配料中心很可能使混合物中的Fe2O3与Fe物质的量之比接近于??????。
(4)在一次制备Fe3O4的实验中,由于配料中心反应物比例控制不当,获得了另一种产品FexOy。取一定量该产品溶于足量盐酸中,还需通入标准状况下224 mLCl2才能把溶液中的Fe2+全部氧化为Fe3+,然后把所得溶液滴加足量NaOH溶液,将沉淀过滤、洗涤、蒸干,灼烧至恒重,得8 g固体。计算该产品的化学式。(请写出计算过程)
参考答案:(1)有利于加快反应池中反应速率
(2)取2份待检液
本题解析:
试题分析:(1)在制备过程中将块状固体原料粉碎磨成粉末,作用是增大反应物的接触面积,有利于加快反应池中反应速率 。(2)由于Fe3O4不溶于水但能溶于酸,如与盐酸反应的产物中含有Fe2+、Fe3+,可分别对两种离子进行检验,根据提供的试剂方法如下:取2份待检液,其中一份待检液滴入KSCN溶液,若显示血红色则含有Fe3+,再向另一份待检液滴入酸性高锰酸钾溶液,若紫红色褪去则含有Fe3+。(3)没有气体产生,说明铁刚好使三价铁转化为二价铁,由于在1molFe3O4中可以认为有二价的氧化亚铁和三价的三氧
本题难度:一般
3、填空题 (12分)湄潭中学某化学兴趣小组利用铁锈(Fe2O3)做了系列实验,物质间关系图如下。根据所学知识回答相关问题:
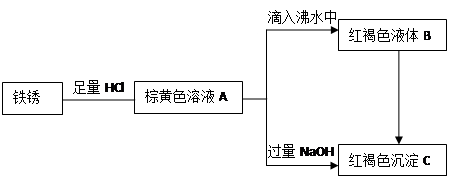
(1)写出A 、B、C三种物质的名称:
A??????????????????B????????????????????C????????????
(2)写出由A滴入沸水中制备B的离子方程式:???????????????????????????????????????
(3)兴趣小组讨论了多种使B转换为C的方法,请写出你认为可行的一种方法:?????????????????????????????????????????????????
(4)下列说法正确的有(填序号):?????????????????
①B转换为C的过程发生了化学反应
②由A制备B时,加热越久越好
③物质B具有丁达尔效应
④把B、C的混合物过滤,滤液无色透明
⑤整个系列反应,都不涉及氧化还原反应
参考答案:(1)氯化铁溶液??氢氧化铁胶体??氢氧化铁沉淀
(2
本题解析:
试题分析:根据题干可以找出物质,铁锈与盐酸反应,生成氯化铁和水,则A是氯化铁溶液,氯化铁加入沸水中可以生成氢氧化铁胶体,B是氢氧化铁胶体,氯化铁与氢氧化钠可以生成氢氧化铁和氯化钠,则C是氢氧化铁沉淀;制取胶体的反应要注意写胶体不要写出沉淀符号:Fe3++3H2O Fe(OH)3(胶体)+3H+;由氢氧化铁
Fe(OH)3(胶体)+3H+;由氢氧化铁
本题难度:一般
4、实验题 (15分)硬质玻璃管是化学实验中经常使用的一种仪器,请分析下列实验(固定装置略)并回答问题。
Ⅰ、进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表。请填写表中的空白:

棉球
| 棉球上滴加的试剂
| 实验现象
| 解释和结论
|
a
| ???????????????????
| 棉球变白,微热后又恢复红色
| ?????????????????????????????
|
b
| 含酚酞的NaOH溶液
| 棉球变为白色
| 离子方程式:????????????????????????????????
|
c
| ?
??????????????????
| 棉球变为白色
| 该气体具有????????????????(选填“氧化性”或“还原性”)
?
Ⅱ、硬质玻璃管与其它装置结合完成定性或定量实验。下图是某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究的装置。

实验一:铁矿石中含氧量的测定???
(1)按上图组装仪器(夹持仪器均省略),检查装置的气密性;
(2)将10.0g铁矿石放入硬质玻璃管中;
(3)从左端导气管口处不断地缓缓通入H2,???????????????????????后,点燃A处酒精灯;
(4)充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(5)测得反应后装置B增重2.70g,则铁矿石中氧的质量分数为______________________。
实验二:铁矿石中含铁量的测定
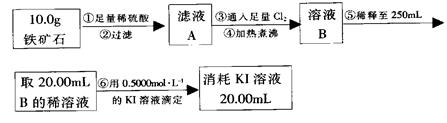
(1)步骤②和⑤中都要用到的玻璃仪器是?????????????__。
(2)下列有关步骤⑥的操作中说法不正确的是_______。
a.滴定管用蒸馏水洗涤后再用待装液润洗
b.锥形瓶需要用待测液润洗
c.因为碘水为黄色,所以滴定过程中不需加指示剂
实验结论:推算铁的氧化物的组成,由实验一、二得出该铁矿石中铁的氧化物的化学式为???????
参考答案:Ⅰ
棉球
棉球上滴加的试剂
现象
解
本题解析:
试题分析:Ⅰ、a、品红试液是红色的,二氧化硫能使品红褪色,漂白原理是:SO2与品红反应生成无色不稳定物质,遇热分解又生成SO2和品红,又恢复红色;
b、氢氧化钠遇到酚酞也是红色的,二氧化硫能和氢氧化钠反应导致红色消失,反应原理是:SO2+OH-=HSO3-;
c、碘单质遇到淀粉变为蓝色,二氧化硫能将碘单质还原为碘离子,SO2+I2+2H2O=H2SO4+2HI,从而使蓝色消失;
Ⅱ、实验一:(1)(2)测的反应后装置B增重2.70g,根据反应的实质,增加的是氧元素的质量,所以氧元
本题难度:困难
5、选择题 铁是一种应用广泛的金属。下列有关铁的说法正确的是
A.铁与盐酸反应生成氯化铁和氢气
B.常温下铁在浓硫酸中钝化
C.铁在氧气中燃烧生成物为三氧化二铁
D.纯铁(块状)是黑色金属
参考答案:B
本题解析:
试题分析:.铁与盐酸反应生成氯化亚铁和氢气,A不正确;B正确,C不正确,铁在氧气中燃烧生成四氧化三铁。纯铁是银白色金属,D不正确,答案选B。
点评:该题是识记性知识的考查,难度不大。平时注意知识的积累和总结,并能灵活运用即可,有利于巩固基础,通过学生的应试能力。
本题难度:一般
|