微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)(1)常温下,向20 mL 0.2 mol·L-1H2A溶液中滴加0.2 mol·L-1NaOH溶液。有关微粒物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。请根据图示填空:
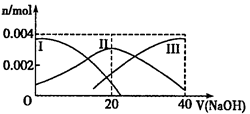
①当V(NaOH)=20mL时,溶液中离子浓度的大小关系: ___________________;
②等体积、等物质的量浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水_________(填“大”、“小”或“相等”),欲使NaHA溶液呈中性,可以向其中加入___________。
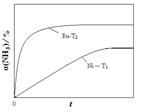
(2)氨气分解反应的热化学方程式如下:2NH3(g) N2(g)+3H2(g) △H=+92.4kJ·mol-1研究表明金属催化剂可加速氨气的分解。图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率。
N2(g)+3H2(g) △H=+92.4kJ·mol-1研究表明金属催化剂可加速氨气的分解。图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率。
①不同催化剂存在下,氨气分解反应的活化能最大的是__________(填写催化剂的化学式)。
②恒温(T1)恒容时,用Ni催化分解初始浓度为c0的氨气,并实时监测分解过程中氨气的浓度。计算后得氨气的转化率α(NH3)随时间t变化的关系曲线(见图2)。请在图2中画出:如果将反应温度提高到T2,Ru催化分解初始浓度为c0的氨气过程中α(NH3)—t的总趋势曲线(标注Ru—T2)

③假设Ru催化下温度为T1时氨气分解的平衡转化率为40%,则该温度下此分解反应的平衡常数K与c0的关系式是:K=_____________。
参考答案:(10分)(1)①C(Na+)>C(HA-)>C(H+)>C
本题解析:
试题分析:(10分)(1)①当氢氧化钠的体积为20毫升时,反应只生成NaHA,根据图像,溶液显酸性,电离大于水解,所以离子浓度关系为C(Na+)>C(HA-)>C(H+)>C(A2-)>C(OH-);②当二者等浓度等体积混合时,溶质为NaHA,溶液显酸性,电离大于水解,所以抑制水的电离,水的电离程度比纯水的小;要使溶液显中性,需要加入碱或碱性物质。(2)①氨气分解反应的活化能最大的说明反应速率最慢,从图分析,使用Fe做催化剂时反应最慢。②如果将反应温度提高到T2,Ru催化分解,反应速率加快,先达到平衡,氨气的由于温度升高,促进分解,氨气的分解转化增大,所以曲线为:
③氨气分解的平衡转化率为40%,则分解的氨气的浓度为c0*40%,生成氮气的浓度为c0*40%/2,氢气的浓度为c0*40%*3/2,则平衡常数为(c0×40%/2)(c0×40%×3/2)3/c0-c0×40%)2=0.12c02。
考点:酸碱混合后溶液酸碱性的判断,催化剂对反应速率和平衡的影响,化学平衡常数的计算
本题难度:困难
2、填空题 (4分)0.1mol/L的HCN溶液与0.1mol/L的NaCN溶液等体积混合,混合后溶液的pH>7,说明:HCN的电离程度 CN-的水解程度;离子浓度大小顺序为 电荷守恒__________ ;物料守恒_____
参考答案:小于 c(N
本题解析:
试题分析:混合后溶液的pH>7,说明此溶液显碱性,进一步说明CN-的水解强于HCN的电离。溶液中离子的浓度大小为c(Na+)>c(CN-)>c(OH-)>c(H+);电荷守恒:c(Na+)+c(H+)=c(CN-)+c(OH-),物料守恒:c(CN-)+ c(HCN)=0.1mol/L。
考点:电解质溶液
点评:本题考查了电解质溶液的相关知识,解题过程中应掌握以下规律:①对于溶液酸碱性的判断,可以从弱离子的电离与水解入手,比较离子浓度的大小。②对于溶液中离子浓度大小的比较,在考虑弱离子的电离水解后,应注意任何溶液中均存在着水的电离。
本题难度:一般
3、选择题 下列电离方程式错误的是( ? )
A.NaHCO3=Na++HCO3-
B.NaHSO4═Na++H++SO42-
C.H2SO4═2H++SO42-
D.KClO3═K++Cl-+3O2-
参考答案:D
本题解析:
本题难度:一般
4、计算题 (1) 常温下,已知0.1 mol·L-1一元酸HA溶液中c(OH-) / c(H+)=1×10-8。
①常温下,0.1 mol·L-1 HA溶液的pH= ;写出该酸(HA)与NaOH溶液反应的离子方程式: ;
②pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是: 。
(2) 常温下,向pH=a的氨水中加入等体积盐酸时,溶液呈中性,则此盐酸的pH 14-a(>、<、=)
(3) 向物质的量浓度均为0.01mol·L-1的MnCl2和BaCl2混合溶液中,滴加Na2CO3溶液,先沉淀的离子是 ,当两种难溶电解质共存时,溶液中c(Ba2+)/c(Mn2+) 。(此温度下,Ksp(BaCO3)=8.1×10-9、Ksp(MnCO3)=1.8×10-11)
(4)设Ka、Kh、Kw分别表示CH3COOH的电离平衡常数、CH3COO-的水解平衡常数和水的离子积常数,则三者之间的关系为:
参考答案:(14分)
(1)①3 , HA+OH-=A-+H2O
本题解析:
试题分析:(1)①c(OH-)/c(H+)=1×10-8,c(OH-)×c(H+)=1×10-14,所以c(OH-)=10-11mol·L-1,则c(H+)=10-3mol·L-1,所以溶液的pH=3;氢离子浓度小于酸的浓度,所以该酸是弱酸,该酸(HA)与NaOH溶液反应的离子方程式为:HA+OH-
本题难度:困难
5、填空题 某学生用0.10 mol/L标准NaOH溶液滴定某浓度的盐酸。记录数据如下:
实验序号
| 待测液体积(mL)
| 所消耗NaOH标准液的体积(mL)
|
滴定前
| 滴定后
|
1
| 20.00
| 0.50
| 20.54
|
2
| 20.00
| 6.00
| 26.00
|
3
| 20.00
| 1.40
| 21.36
(1)滴定时选用酚酞试液作指示剂,如何判断滴定达到终点 。
(2)盐酸的物质的量浓度为_____________
(3)碱式滴定管尖嘴部分有气泡,滴定后消失,对测定结果的影响是 (填“偏高”或“偏低”或“无影响”,下同)。
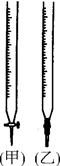
(4)某同学用已知准确浓度的高锰酸钾溶液滴定溶液中Fe2+的浓度,高锰酸钾溶液应盛放在 中(填“甲”或“乙”),该反应的离子方程式为: 。
参考答案:(1)当滴入最后一滴标准液,溶液由无色变为浅红色,且半分钟内
本题解析:
试题分析:(1)因为这是由已知浓度的碱滴定未知浓度的酸,酚酞指示剂在酸溶液中,是无色的,随着碱的滴加,溶液的酸性逐渐减弱,当滴加到最后一滴时,溶液由无色变为浅红色,半分钟内不褪色时酸碱中和恰好完成。(2)碱溶液的平均体积为V=(V1+V2+V3)÷3=" ((20.54-0.05)+(26.00-6.00)" +(21.36-1.40)) ÷3=20.00ml,利用酸碱恰好发生中和反应时C酸??V酸=C碱?V碱,C酸="(" C碱?V碱) ÷V酸="(0.10" mol/L×20.00ml) ÷20.00ml="0.10mol/L." (3)若在滴定前碱式滴定管尖嘴部分有气泡,滴定后消失,碱溶液的体积偏大,以此为标准计算的酸的浓度偏高。(4)若用已知准确浓度的高锰酸钾溶液滴定溶液中Fe2+的浓度,由于高锰酸钾溶液有强的氧化性,容易腐蚀碱式滴定管的橡胶管,所以应盛放在酸式滴定管甲中,发生该反应的离子方程式为5Fe2+ + MnO4- + 8H+ = 5Fe2+ + Mn2+ + 4H2O。
考点:考查滴定法的应用、酸碱中和滴定终点的判断、误差分析等知识。
本题难度:一般
|