2.0×10-29
?
现有某种KNO3溶液,其中混有少量KBr和Ca(H2PO4)2杂质,可供选择的试剂有:①AgNO3,②K2CO3,③KOH,④HNO3。若规定不得重复使用试剂,且最后溶液中只允许含有K+、NO3-和少量H+、OH-,则加入试剂顺序正确的是
A.③①②④
B.①③②④
C.②①③④
D.①②③④
参考答案:A
本题解析:略
本题难度:简单
2、选择题 已知AgI为黄色沉淀,AgCl为白色沉淀。25℃时,AgI饱和溶液中c(Ag+)为1.22×10-8 mol/L,AgCl饱和溶液中c(Ag+)为1.30×10-5 mol/L若在5 mL含有KCl和KI浓度均为0.01 mol/L的混合溶液中,滴加8mL0.?01 mol/L的AgNO3溶液,则下列叙述中不正确的是 [???? ]
A. 溶液中所含溶质的离子浓度大小关系为:c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-)
B. 溶液中先产生的是AgI沉淀
C. AgCl的Ksp的数值为1.69×10-10
D. 若在AgI悬浊液中滴加少量的KCl溶液,黄色沉淀不会转变成白色沉淀
参考答案:A
本题解析:
本题难度:一般
3、选择题 在一定温度下,当Mg(OH)2固体在水溶液中达到下列平衡时:Mg(OH)2 Mg2++2OH-,要使Mg(OH)2固体减少而c(Mg2+)不变,可采取的措施是???????? ( ) Mg2++2OH-,要使Mg(OH)2固体减少而c(Mg2+)不变,可采取的措施是???????? ( )
A.加MgSO4
B.加HCl溶液
C.加NaOH
D.加少量水
参考答案:D
本题解析:MgSO4易溶于水,加MgSO4会增加c(Mg2+),A错误;加HCl溶液会中和OH-平衡右移,使c(Mg2+)增大,B错误;加NaOH使c(OH-)增大平衡左移,c(Mg2+)减小,C错误;加少量水时c(Mg2+)减少,平衡右移重新达到平衡时,c(Mg2+)又与原平衡相同,D正确。
本题难度:一般
4、选择题 下表是五种银盐的溶度积常数(25℃)
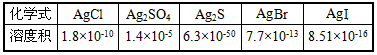
下列说法错误的是[???? ]
A.五种物质在常温下溶解度最大的是Ag2SO4
B.将氯化银溶解于水后,向其中加入Na2S,则可以生成黑色沉淀
C.氯化银、溴化银和碘化银三种物质在常温下的溶解度随着氯、溴、碘的顺序增大
D.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡也会发生移动
参考答案:C
本题解析:
本题难度:一般
5、填空题 (10分)据《辽沈晚报》报道,今年冬天,一旦出现大气严重污染的天气,沈阳市有可能建议政府机关、企事业单位根据实际情况实行员工休假或弹性工作制。大气含有的CO、氮氧化物、SO2、烟尘等污染是导致雾霾天气的原因之一,化学反应原理是减少和控制雾霾天气的理论依据。
(1)CO2经常用氢氧化钠来吸收,现有0.4molCO2,若用200ml 3mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为:
(2) CO可制做燃料电池,以KOH溶液作电解质,向两极分别充入CO和空气,工作过程中,负极反应方程式为:___________________。
(3) 利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-,从而实现对SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为 ;
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
(5)已知在常温常压下:
①CH3OH(l)+O2(g)= CO(g)+2H2O(g) △H=" -359.8" kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g) ?△H=" -556.0" kJ·mol-1
③ H2O(g)=H2O(l)?△H=" -44.0" kJ·mol-1
写出体现甲醇燃烧热的热化学方程式 。
参考答案:(1) c(Na+)>c(HCO3-)>c(CO
本题解析:
试题分析:(1)n(CO2)=" 0.4mol" ,n(NaOH)= 0.2L×3mol/L=0.6mol.假设反应后产物中含Na2CO3、NaHCO3 的物质的量分别是x、y,则根据C元素守恒可得x+y=0.4mol;根据Na元素守恒可得2x+y=0.6mol。解得x=y=0.2mol。所以溶液是Na2CO3、NaHCO3等物质的量浓度的混合溶液。根据物料守恒可知离子浓度最大的是c(Na+)。由于二者都要水解消耗水电离产生的H+,所以最终溶液中c(OH-)>c(H+),而CO32-水解的程度大于HCO3-的水解程度,所以c(HCO3-)>c(CO32-);但是盐的水解程度是微弱的,在溶液中主要还是以盐电离产生的离子存在,盐电离产生的离子浓度远大于弱电解质水的电离产生的离子,所以c(CO32-)>c(OH-)。溶液中离子浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);(2) CO可制做燃料电池,以KOH溶液作电解质,向两极分别充入CO和空气,工作过程中,通入燃料的电极是负极,电极反应方程式为CO+4OH—-2e-=CO32-+2H2O;(3) 由于Fe2+、Fe3+对SO2的转化有催化作用,常温下将SO2转化为SO42-,从而实现对SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为2Fe3++SO2+2H2O=SO42-+2Fe2++4H+;(4)假设生成沉淀所需CaCl2溶液的最小浓度为x,由于溶液等体积混合时各种物质的浓度都减小一半,所以 (x/2)×[(2×10—4mo1/L)÷2]≥2.8×10—9=5.6×10-5mol/L;(5)①+②÷2+③×2,整理可得:CH3OH(L)+3/2O2(g)=CO2(g)+2H2O(l)ΔH=-725.8KJ/mol。
考点:考查微粒浓度的比较、燃料电池电极反应式和离子方程式、热化学方程式的书写的知识。
本题难度:困难
|