6.51
(5)若不考虑其它条件,根据上表数据,制取高纯度阻燃剂最佳条件是 (填字母)。
①40℃ ②60℃ ③EDTA质量为O.05g
④EDTA质量为0.10g ⑤保险粉质量为0.05g ⑥保险粉质量为0.10g
A.①③⑤ B.②④⑥ C.①④⑥ D.②③⑤
参考答案: (15分)
(1) 本题解析:略 本题解析:略
本题难度:困难
2、填空题 (10分)试回答下列各问题:
(1)如图Ⅰ所示是1 mol NO2和CO反应生成 CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: 。
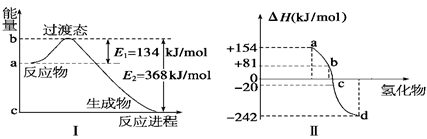
(2)化学反应的焓变与反应物和生成物的键能有关。
①已知:H2(g)+Cl2(g) ="==" 2HCl(g) ΔH="-185" kJ/mol;
键能ΔH298(H—H)="436" kJ/mol,ΔH298(Cl—Cl)="247" kJ/mol,则ΔH298(H—Cl)= 。
②图Ⅱ表示氧族元素中的氧、硫、硒(Se)、碲生成氢化物时的焓变数据,根据这组焓变数据可确定a、b、c、d分别代表的元素,试写出硒化氢发生分解反应的热化学方程式: 。
(3)已知: ①Fe2O3(s)+3CO(g)  2Fe(s)+3CO2(g) ΔH="-a" kJ/mol 2Fe(s)+3CO2(g) ΔH="-a" kJ/mol
②3Fe2O3(s)+CO(g)  2Fe3O4(s)+CO2(g) ΔH="-b" kJ/mol 2Fe3O4(s)+CO2(g) ΔH="-b" kJ/mol
③Fe3O4(s)+CO(g)  3FeO(s)+CO2(g) ΔH="+ckJ/mol" 3FeO(s)+CO2(g) ΔH="+ckJ/mol"
则FeO(s) +CO(g)  Fe(s)+CO2(g) ΔH=- 。 Fe(s)+CO2(g) ΔH=- 。
参考答案:(1)NO2(g)+CO(g) ="==" NO(g)+CO
本题解析:(1)根据图Ⅰ可知反应物的总能量高于生成物的总能量,是放热反应,放出的热量是368kJ/-134 kJ=234 kJ,所以热化学方程式为NO2(g)+CO(g) ="==" NO(g)+CO2(g) ΔH="-234" kJ/mol。
(2)②反应热就是断键吸收的能量和形成化学键所放出的能量的差值,因此ΔH="=436" kJ/mol+247 kJ/mo-2X=-185 kJ/mo,解得X=434 kJ/mol。
①非金属性越强,和氢气化合越剧烈,放出的热量就越多。所以a、b、c、d分别代表的元素是碲、硒(Se) 、硫、氧。生成硒化氢的反应是吸热反应,则逆反应就是放热反应,所以硒化氢发生分解反应的热化学方程H2Se(g) ="==" Se(s)+H2(g) ΔH="-81" kJ/mol。
(3)根据盖斯定律可知,①×3-②-③×2即得到6FeO(s) +6CO(g)  6Fe(s)+6CO2(g),所以反应热为ΔH= -(3a-b+2c)kJ/mol。 6Fe(s)+6CO2(g),所以反应热为ΔH= -(3a-b+2c)kJ/mol。
本题难度:一般
3、选择题 如图图示与对应的叙述相符的是( )
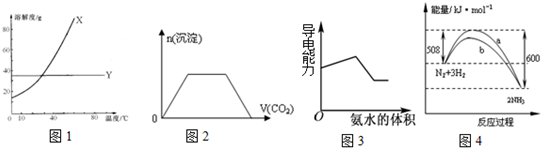
A.图1表明可用蒸馏法分离X、Y
B.图2表示向Ba(OH)2、KAlO2混合溶液中通入CO2
C.图3表示表示向盐酸和醋酸混合溶液中滴入氨水
D.图4表示曲线b过程的热化学方程式:N2(g)+3H2(g)=2NH3(g)△H=-92?kJ/mol
参考答案:D
本题解析:
本题难度:简单
4、选择题 已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol???? CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802kJ/mol
H2O(g)=H2O(l)△H=-44KJ/mol?? 则CH4在空气中不完全燃烧时,热化学方程式是( )
A.2CH4(g)+3.5O2(g)=CO2(g)+CO(g)+4H2O(g)△H=-1038kJ/mol
B.4CH4(g)+7O2(g)=2CO2(g)+2CO(g)+8H2O(l)△H=-2642kJ/mol
C.2CH4(g)+3.5O2(g)=CO2(g)+CO(g)+4H2O(g)△H=-1497kJ/mol
D.2CH4(g)+3.5O2(g)=CO2(g)+CO(g)+4H2O(l)△H=-1497kJ/mol
参考答案:D
本题解析:
本题难度:一般
5、填空题 (共8分)
(1)物质的量浓度相同的①氨水;②氯化铵;⑧碳酸氢铵;④硫酸氢铵;⑤硫酸铵5种溶液中c(NH4+)的大小顺序是______,溶液pH的大小顺序是______。
(2)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其 ..CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为 ..CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为 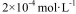 ,则生成沉淀所需CaCl2溶液的最小浓度为 。 ,则生成沉淀所需CaCl2溶液的最小浓度为 。
(3)己知: 
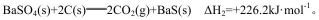
则反应 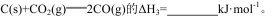
参考答案:每空2分,共8分
(1)⑤>④>②>③>①
本题解析:
试题分析:(1)一水合氨是弱电解质,在水溶液中部分电离,所以浓度相同的这几种溶液中,氨水的铵根离子浓度最小,硫酸铵中铵根离子个数是2,所以硫酸铵中铵根离子浓度最大,碳酸氢根离子促进铵根离子水解、氢离子抑制铵根离子水解,所以氯化铵、碳酸氢铵、硫酸氢铵中铵根离子浓度大小顺序是④>②>③,则相同浓度的这几种溶液中c(NH4+)的由大到小顺序是⑤>④>②>③>①;一水合氨是弱碱,溶液呈碱性,溶液碱性最强;硫酸氢铵溶液为强酸性溶液,pH最小,碳酸氢根离子促进铵根离子水解,硫酸铵中铵根离子水解个数大于氯化铵,所以相同浓度的这几种溶液中,溶液pH的由大到小顺序是①>③>②>⑤>④;
(2)根据反应Ca2++CO32-=CaCO3,C(Ca2+)·C(CO32-)=2.8×10-9,C(Ca2+)= 2.8×10-9/1=2.8×10-9mol/L,由于是等体积的CaCl2溶液与Na2CO3溶液混合,所以生成沉淀所需CaCl2溶液的最小浓度为2.8×10-9mol/L×2=5.6×10-5mol·L-1 ;
(3)根据盖斯定律,(△H1-△H2)÷2=(+571.2-226.2)÷2=+172.5。
考点:考查盐类水解,PH值的大小比较,沉淀溶解平衡的应用,盖斯定律的应用等知识。
本题难度:一般
|