微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 草酸亚铁(FeC2O4)常用作分析剂、显影剂以及新型电池材料磷酸亚铁锂的生产。
I.某兴趣小组对草酸亚铁的分解产物进行实验和探究。
(1)已知CO能与氯化钯(PdCl2)溶液反应生成黑色的钯粉。
将草酸亚铁分解产生的气体依次通过A(澄清石灰水)和B(氯化钯溶液),观察到A中澄清石灰水变浑浊,B中有黑色物质生成。由此说明气体产物中含有?????????????????????。
(2)将样品草酸亚铁晶体(FeC2O4·2H2O)在氩气气氛中进行热重分析,结果如下图(TG表示残留固体质量占原样品总质量的百分数)。
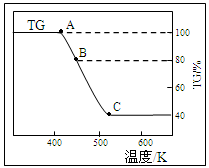
①试确定B点对应固体物质的化学式???????????????;
②写出B C对应的化学方程式?????????????。
C对应的化学方程式?????????????。
II.某草酸亚铁样品(不含结晶水)中含有少量草酸。现用滴定法测定该样品中FeC2O4的含量。
实验方案如下:
①将准确称量的0.20g草酸亚铁样品置于250 mL锥形瓶内,加入适量2 mol/L的H2SO4溶液,使样品溶解,加热至70℃左右,立即用高锰酸钾溶液滴定至终点。
②向滴定终点混合液中加入适量的Zn粉和过量的2 mol/L的H2SO4溶液,煮沸5~8min。用KSCN溶液在点滴板上检验煮沸液,直至溶液不变红,将其过滤至另一个锥形瓶中,用0.02000 mol/L的高锰酸钾标准溶液滴定该溶液至终点,消耗高锰酸钾标准液6.00 ml。
试回答下列问题:
(1)高锰酸钾标准液用????????????滴定管盛装(填“酸式”或“碱式”)。
(2)在步骤①中,滴加高锰酸钾溶液时观察到有无色气体产生,则高锰酸钾与草酸反应的离子方程式为???????????????????????????????????????????????????????????。
(3)在步骤②中,下列操作会引起测定结果偏高的是?????????????。
A.滴定管在盛装高锰酸钾前未润洗
B.滴定过程中,锥形瓶震荡的太剧烈,以致部分液体溅出
C.滴定前读数正确,滴定终点时俯视读数
D.滴定前读数正确,滴定终点时仰视读数
(4)0.20g 样品中 FeC2O4的质量分数为 ??????????????。(不考虑步骤②中的损耗)
参考答案:Ⅰ(1)? CO、CO2(对一个计1分)
(2) ①
本题解析:
试题分析:Ⅰ(1)A中澄清石灰水变浑浊说明气体中含CO2,B中有黑色物质生成,说明含CO气体,答案是CO、CO2
(2)①由图可知,B点时固体质量减少20%,而FeC2O4·2H2O固体中水的含量为20%,所以B点对应固体的化学式为FeC2O4
②从B到C固体质量减少一半,且温度升高,固体质量不再变化,说明此时分解完全,对应的化学方程式为FeC2O4 = FeO+CO↑+CO2↑
Ⅱ(1)高锰酸钾溶液的氧化性很强,易腐蚀碱式滴定管的胶管,应用酸式滴定管盛放
(2)草酸亚铁与
本题难度:一般
2、选择题 FeS与一定浓度HNO3反应,生成Fe2(SO4)3.Fe(NO3)3.NO2.NO和H2O,当NO2和NO的体积为1∶1时实际参加反应的FeS与HNO3的物质的量之比是(???)
A.4∶9
B.2∶9
C.2∶11
D.1∶7
参考答案:C
本题解析:略
本题难度:一般
3、选择题 若金属锰(Mn)在金属活动性顺序中位于铝和锌之间,则下列反应不正确的是(???? )
A??? Mn+2HCl==MnCl2+H2↑?????????B?? Mg+MnSO4==MgSO4+Mn
C??? Mn+Cu(NO3)2==Mn(NO3)2+Cu??? D?? Fe+MnSO4==FeSO4+Mn
参考答案:D
本题解析:
本题难度:一般
4、选择题 下列说法不正确的是
A.金属单质与盐溶液的反应都是置换反应
B.4Fe(OH)2+O2+2H2O=4Fe(OH)3属于化合反应
C.SO2+Cl2+2H2O=2HCl+H2SO4属于氧化还原反应
D.AgNO3+HCl=AgCl↓+ HNO3?该反应不能说明盐酸酸性比硝酸强
参考答案:A
本题解析:
试题分析:A的答案明显错误,Fe和FeCl3的反应时化合反应,当然也是氧化还原反应
点评:化学反应是基础,熟悉各种转化关系,尤其是四种基本反应类型,氧化还原反应。置换反应一定是氧化反应;有单质参加的化合反应是氧化还原反应;有单质生成的分解反应是氧化还原反应;复分解反应一定不是氧化还原反应。只要学生学习过程中牢记并理解这些基本定义,便不难解答此题。
本题难度:简单
5、选择题 用下列方法制取氧气:
①KMnO4受热分解???????????????????②KClO3受热分解(用MnO2作催化剂)?
③2H2O2=2H2O+O2↑(用MnO2作催化剂)???④2Na2O2+2H2O===4NaOH+O2↑
若要制得相同质量的氧气,上述四种方法中所转移的电子数目之比是
A.3∶2∶1∶4
B.1∶1∶1∶1
C.1∶2∶1∶2
D.2∶2∶1∶1
参考答案:D
本题解析:
试题分析:2KMnO4 K2MnO4+O2+MnO2???氧元素又-2价升至0价。生成1摩尔氧气, 要转移4摩尔电子。
K2MnO4+O2+MnO2???氧元素又-2价升至0价。生成1摩尔氧气, 要转移4摩尔电子。
2KClO3 本题难度:一般
本题难度:一般