微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将Fe和Cu的混合粉末加入到100 mL 4 mol/L稀硝酸中充分反应后:
(1)若反应后有Cu剩余,则此溶液中一定有的阳离子是???????,可能有的阳离子是???????????????????。
(2)若反应后的溶液中有Fe3+,则溶液中一定含有的阳离子是???????,可能含有的阳离子是?????????????????????????????????????????????????????????。
(3)如果反应后的溶液中无金属剩余,则加入的金属质量最大为?????????????????????????。
(4)如果加入的Fe和Cu的质量比为7∶8,则使HNO3完全反应的金属最小质量为????????????????????????????????????????????????????????????????????。
参考答案:(1)Fe2+ Cu2+
(2)Cu2+ Fe2+或H
本题解析:本题中要注意的是稀HNO3将铁和铜氧化时的反应顺序:①与Fe反应生成Fe3+;②与Cu反应生成Cu2+;③Fe3+与Fe反应生成Fe2+。(1)若反应后有Cu剩余,则此溶液中一定有的阳离子是Fe2+,可能有的阳离子是Cu2+;(2)若反应后有Fe3+,则此溶液中一定有的阳离子是Cu2+,可能有的阳离子是Fe2+或H+,而这两者不能同时大量存在;(3)由上述的三个过程可知,只发生与铜的反应时所需的金属质量是最大的,由3Cu~8HNO3可解得需Cu的质量最大为9.6 g;(4)因要求金属质量要最小,所以加入的
本题难度:一般
2、选择题&n bsp; 常温下,在某200 mL的稀硫酸和稀硝酸的混合溶液中逐量地加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。(设硝酸只被还原为NO气体, Fe的相对原子质量为56)。下列有关分析错误的是
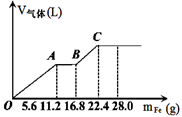
A.原混合酸中NO3-的物质的量为0.2 mol
B.原混合酸中H2SO4物质的量浓度为2mol/L
C.OA段与BC段反应中电子转移的物质的量之比为2:1
D.取20mL原混合酸加水稀释至1L后溶液的pH=1
参考答案:C
本题解析:
试题分析:硝酸是氧化性酸,因此首先与铁反应,即OA段表示铁与硝酸反应生成硝酸铁、NO和水,离子方程式为Fe+4H++NO3-=Fe3++2H2O+NO↑。当NO3-完全被还原后继续介入铁粉,铁离子开始氧化铁粉,即AB段的离子方程式为Fe+2Fe3+=3Fe2+。最后加入铁粉氢离子与铁发生置换反应生成氢气,即BC段反应的离子方程式为Fe+2H+=F2+H2↑,据此可以判断。A、碘A时溶液中的NO3-尾气被还原为NO,此时消耗铁的质量是11.2g,物质的量=11.2g÷56g/mol=0.2mol,则
本题难度:一般
3、填空题 写方程式:
(1)______H2O2+______KMnO4+______H2SO4═______MnSO4+______O2+______K2SO4+______H2O
(2)请写出两个置换反应,要求:(a)非金属单质之间的置换,(b)在方程式中两种非金属单质必需是不同主族的.______,______.
参考答案:(1)反应中物质的化合价变化:KMnO4→MnSO4,Mn元
本题解析:
本题难度:一般
4、填空题 (4分)完成并配平下列化学方程式□FeO + □HNO3——□Fe(NO3)3 + NO↑+ □???,
该反应中氧化剂是????????,当生成2mol NO时,转移的电子数为????????NA。
参考答案:
 本题解析:略
本题解析:略
本题难度:一般
5、选择题 用水热法制备Fe3O4纳米颗粒的总反应如下:
3Fe2++ 2S2O32-+O2+4OH-= Fe3O4 + S4O62-+2H2O。下列说法正确的是(???)
A.在反应中1molO2氧化了3mol Fe2+
B.还原剂是Fe2+,氧化剂是S2O32-和O2
C.每生成1mol Fe3O4,转移3mol电子
D.当转移1mol电子时,消耗56gS2O32-
参考答案:D
本题解析:考查氧化还原反应相关知识点
反应中两个亚铁离子的化合价由+2价升至+3价(Fe3O4中有两个+3价铁), S2O32-中的四个硫全部转变为S4O62-,总体化合价由+8价升至+10价,升高2价,共升高四价;而氧气中氧元素由0价降至—2价,降低四价,反应中有四个电子的转移
所以还原剂为Fe2+、2S2O32-,氧化剂为O2
A:1molO2氧化了2mol Fe2+
B:还原剂为Fe2+、2S2O32-,氧化剂为O2
C:每生成1mol Fe3O4,共转移4mol电子
D:
本题难度:一般