微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 在一定温度下,有盐酸、硫酸、醋酸三种溶液,请按要求回答下列问题:
(1)当三种酸的物质的量浓度相同时,电离出来的c(H+)最大的是__________。
(2)若三者电离出来的c(H+)相同时,三种酸的物质的量浓度最小的是________。
(3)pH相同、体积相同的醋酸溶液和盐酸分别与足量的锌反应,刚开始反应时的反应速率的大小关系为______(填“相等”或者“不等”),相同状况下产生氢气的体积最大的酸是______。pH相同的醋酸溶液和盐酸,分别用蒸馏水稀释至原体积的m倍和n倍,稀释后两溶液pH仍相同,则m和n的关系是:m?????n(填“>”、“=”、“<”)
(4)同体积、同物质的量浓度的醋酸和盐酸两种酸,分别中和同浓度的NaOH溶液,消耗NaOH的体积大小关系为???????(填“相等”或者“不等”)
参考答案:(1)H2SO4(硫酸) ???(2) H2SO4(硫酸)?
本题解析:
试题分析:(1)当三种酸的物质的量浓度相同时,由于盐酸和硫酸是强酸,完全电离,硫酸又是二元酸,而醋酸是弱酸,不完全电离,所以c(H+)最大的是硫酸。(2)三者电离出来的c(H+)相同时,因为醋酸为弱酸,其物质的量浓度远大于溶液中c(H+),而盐酸是一元强酸,硫酸是二元强酸,所以三者的物质的量浓度大小顺序为:c(CH3COOH)>c(HCl)>c(H2SO4),硫酸物质的量浓度最小。(3)pH相同则氢离子浓度相等,所以刚开始反应时的反应速率相等;因为醋酸是弱酸,加水稀释促进电离,稀释相同倍数时H+浓
本题难度:一般
2、选择题 在20mL0.1mol/L 的醋酸溶液中,能使溶液的pH减小,而且使醋酸的电离平衡向逆方向移动,可加入的试剂是
A.20mL水
B.浓盐酸
C.冰醋酸
D.NaOH溶液
参考答案:B
本题解析:
试题分析:醋酸电离方程式为:CH3COOH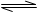 CH3COO-+H+,若使溶液PH降低,且平衡像逆反应方向移动。A选项错误,加水后PH增大,稀释溶液平衡向正反应方向移动。B选项正确。加入浓盐酸后
CH3COO-+H+,若使溶液PH降低,且平衡像逆反应方向移动。A选项错误,加水后PH增大,稀释溶液平衡向正反应方向移动。B选项正确。加入浓盐酸后
PH降低,H+浓度增大,平衡向逆反应方向移动。C选项,加入冰醋酸,PH减小,但平衡向正反应方
向移动。
本题难度:一般
3、选择题 常温下,0.1 mol/L某一元酸(HA)溶液中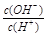 =1×10-8,下列叙述正确的是(? )
=1×10-8,下列叙述正确的是(? )
A.溶液中水电离出的c(H+)=10-10 mol/L??
B.溶液中c(H+)+c(A-)=0.1 mol/L
C.溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH-)均增大
D.与0.05mol/LNaOH溶液等体积混合后所得溶液中离子浓度大小关系为c(A-)>c(Na+)>c(OH-)>c(H+)
参考答案:C
本题解析:
试题分析:0.1 mol/L某一元酸(HA)溶液中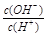 =1×10-8,而溶液中c(H+)·c(OH-)=10-14.解得c(OH-)=10-11.所以c(H+)10-3mol/L<c(HA),所以该酸是弱酸。A.所以溶液中水电离出的c(H+)=c(OH-)=10-11 mol/L。错误。B.根据物料守
=1×10-8,而溶液中c(H+)·c(OH-)=10-14.解得c(OH-)=10-11.所以c(H+)10-3mol/L<c(HA),所以该酸是弱酸。A.所以溶液中水电离出的c(H+)=c(OH-)=10-11 mol/L。错误。B.根据物料守
本题难度:一般
4、选择题 下列示意图中,正确的是( )
A.
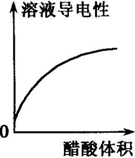
烧碱溶液中滴加稀醋酸
B.
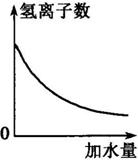
稀醋酸加水稀释
C.
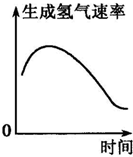
镁与一定量的盐酸反应
D.

加热纯碱溶液
参考答案:C
本题解析:
本题难度:一般
5、选择题 下列事实一定能证明HNO2是弱电解质的是(??)
A.用HNO2溶液做导电实验,灯泡很暗;
B.0.1 mol/L HNO2溶液的pH=2.1
C.HNO2不是离子化物,而是共价化合物
D.HNO2和NaCl不能发生反应
参考答案:B
本题解析:
试题分析:A项溶液导电性强弱与溶液中的离子浓度和离子所带电荷有关,与电解质的强弱无关,B项0.1 mol/L HNO2溶液的pH=2.1,说明HNO2没有完全电离,可以证明是弱电解质,C项共价化合物也有强电解质,如HCl,D项不能用是否发生化学反应来判断强弱电解质。答案选B。
点评:弱电解质的证明,是基于与强电解质对比进行的。弱电解质与强电解质最大的区别就是弱电解质存在电离平衡,而强电解质不存在电离平衡。因此只要证明有电离平衡存在,就证明了弱电解质。弱酸 CH3COOH的证明方法有:①测定一
本题难度:一般