微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 常温下将0.1 mol/L甲酸(HCOOH)溶液加水稀释, 下列说法正确的是?
[???? ]
A.溶液中c(H+)和c(OH-)都减小
B.溶液中c(H+)/c(HCOOH)减小
C.HCOO-离子的数目增大
D.溶液的pH减小
参考答案:C
本题解析:
本题难度:一般
2、选择题 液氨溶解金属钠后成为蓝色的导电性很强的溶液,其颜色被认为是电子的氨合[e-(NH3)n]引起的。若放置 后,蓝色逐渐褪去,蒸发褪色后的溶液得到白色氨基钠( NaNH2),反应的化学方程式为:2Na+2NH3== 2NaNH2+H2↑。下列说法中不正确的是[???? ]
A.溶液褪色的速率与逸出氢气的速率成正比
B.液氨中有如下平衡:2NH3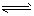 NH4++NH2-
NH4++NH2-
C.液氨是一种非电解质,只有在水中才能电离
D.碱金属的液氨溶液是一种强还原剂
参考答案:C
本题解析:
本题难度:一般
3、选择题 某二元酸(H2A)在水中的电离方程式为:H2A = H+ + HA- ??HA- H+ + A2- (Ka=1.0×10-2),下列说法正确的是
H+ + A2- (Ka=1.0×10-2),下列说法正确的是
A.在0.1 mol·L-1的H2A溶液中,c(H+)> 0.12 mol·L-1
B.在0.1 mol·L-1的Na2A溶液中,c(A2-)+ c(HA-)+ c(Na+)=" 0.2" mol·L-1
C.分别将同浓度(0.1 mol·L-1)的NaHA和Na2A溶液等体积混合,其pH一定小于7
D.0.1 mol·L-1的NaHA溶液中离子浓度为:c(Na+)>c(H+)>c(HA-)>c(A2-)>c(OH-)
参考答案:C
本题解析:
试题分析:A. 在0.1 mol·L-1的H2A溶液中,首先发生电离:H2A = H+ + HA- ,这步是完全的、彻底的,然后发生电离:HA- H+ + A2-。由于第一步的电离对第二步的电离起抑制作用,所以c(H+)< 0.12 mol·L-1。错误。B. 在0.1 mol·L-1的Na2A溶液
H+ + A2-。由于第一步的电离对第二步的电离起抑制作用,所以c(H+)< 0.12 mol·L-1。错误。B. 在0.1 mol·L-1的Na2A溶液
本题难度:一般
4、选择题 (6分)(2012?广东)对于常温下pH为2的盐酸,传述正确的是( )
A.c(H+)=c(Cl﹣)+c(OH﹣)
B.与等体积pH=12的氨水混合后所得溶液显酸性
C.由H2O电离出的c(H+)=1.0×10﹣12 mol?L﹣1
D.与等体积0.01 mol?L﹣1乙酸钠溶液混合后所得溶液中:c(Cl﹣)=c(CH3COO﹣)
参考答案:AC
本题解析:A、依据溶液中电荷守恒分析;
B、一水合氨是弱电解质存在电离平衡;
C、盐酸溶液中,酸对水的电离起到抑制作用,依据溶液中离子积常数计算得到;
D、依据反应生成物分析,溶液显酸性;结合电荷守恒分析判断;
解:A、常温下PH为2的盐酸溶液中电荷守恒可知,c(H+)=c(Cl﹣)+c(OH﹣),故A正确;
B、一水合氨是弱电解质存在电离平衡,与等体积PH=12的氨水混合后,一水合氨会继续电离出氢氧根离子,氨水过量,显碱性,故B错误;
C、常温下PH为2的盐酸溶液中c(H+)=
本题难度:一般
5、选择题 有两种一元弱酸的钠盐溶液,其物质的量浓度相等,现向这两种盐的溶液中分别通入适量的CO2,发生如下反应:NaR+CO2+H2O=HR+NaHCO3 2NaR1+CO2+H2O 2HR1+Na2CO3;HR和HR1的酸性强弱比较,正确的是 [???? ]
2HR1+Na2CO3;HR和HR1的酸性强弱比较,正确的是 [???? ]
A.HR较弱
B.HR1较弱
C.两者相同
D.无法比较
参考答案:B
本题解析:
本题难度:一般