微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应N2(g)+3H2(g)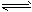 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
_________移动(填“向左”、“向右”或“不”);使用催化剂,反应的△H________ (填“增大”、“减小”或“不改变”)。
(2)已知:
O2(g) = O2+(g)+e- △H1=1175.7 kJ·mol-1
PtF6(g)+e-=PtF6-(g) △H2=-771.1 kJ·mol-1
O2PtF6(s)=O2+(g)+PtF6-(g) △H3=482.2 kJ·mol-1
则反应O2(g)+PtF6(g) =O2PtF6(s)的△H=_____________kJ·mol-1。
(3)已知:25℃时Ksp=1.8×10-11,Ksp=2.2×10-20。在25℃下,向浓度均为0.1 mol·L-1的MgCl2和
CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为
________________。
(4)在25℃下,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-)。则溶液显_____性(填“酸”、“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=________。
参考答案:(1)向左;不改变
(2)-77.6
(3)
本题解析:
本题难度:一般
2、选择题 0.01 mol/L的H2S溶液中,下列关系正确的是
mol/L的H2S溶液中,下列关系正确的是
A.c(H+)=c(OH-)+c (HS-)+c(S2-)
(HS-)+c(S2-)
B.c(H2S)>c(HS-)>c(H+)>c(OH-)
C.c(H2S)>c(H+)>c(HS-)>c(S2-)
D.c(S2-)+c(HS-)+ c(H2S)=0.01mol/L
参考答案:CD
本题解析:略
本题难度:一般
3、选择题 可以判定某酸HA是弱电解质的事实是
A.HA能与水以任意比互溶
B.0.1 mol·L-1HA溶液的pH约为3
C.HA可与NaHCO3反应放出CO2
D.HA溶液的导电能力很差
参考答案:B
本题解析:
试题分析:判断物质是弱电解质的依据是该物质部分电离,存在电离平衡。所以HA的水溶性与电离无关,A错误;0.1 mol·L-1HA溶液的pH约为3即c(H+)="0.001" mol·L-1 ,所以说明HA不完全电离,是弱酸,B正确;HA与NaHCO3反应放出CO2 只能说明酸性HA>H2CO3,但不能说明是弱酸,所以C错误;水溶液导电能力与溶液中的离子浓度有关,所以D错误,故选D。
本题难度:一般
4、选择题 下列物质中,属于弱电解质的是
A.氯化氢
B.碳酸氢钠
C.一水合氨
D.二氧化硫
参考答案:C
本题解析:
试题分析:A、氯化氢是强酸,属于强电解质,错误;B、碳酸氢钠属于盐,是强电解质,错误;C、一水合氨是弱碱,属于弱电解质,正确;D、二氧化硫不是电解质,错误,答案选C。
考点:考查弱电解质的判断
本题难度:一般
5、选择题 下列有关强、弱电解质的叙述正确的是
A.强电解质溶液的导电性一定比弱电解质溶液的导电性强
B.强电解质的水溶液中不存在溶质分子
C.强电解质都是离子化合物,而弱电解质都是共价化合物
D.不同的弱电解质只要物质的量浓度相同,电离程度也相同
参考答案:B
本题解析:
试题分析:A、溶液导电能力取决于溶液中离子浓度大小,强电解质溶液的导电性不一定比弱电解质溶液的导电性强,A错误;B、强电解质的特征是水溶液中完全电离,所以不存在溶质分子,B正确;C、离子化合物都是强电解质,但强电解质不一定是离子化合物;弱电解质都是共价化合物,但共价化合物不一定是弱电解质;C错误;D、不同弱电解质电离程度由本性决定,浓度相同的弱电解质溶液中电离程度不一定相同,D错误;选B。
考点:考查强弱电解质的定义和性质。
本题难度:一般