微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (4分)配平氧化还原反应方程式。
(1) NH3+ NO2— N2+ H2O
(2) 氧化产物与还原产物的质量比为 。
参考答案:(4分)(1)8 6 14 12 &#
本题解析:本题考查氧化还原反应方程式的配平
(1)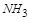 中
中 ,
,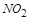 中
中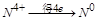 ,得失电子数的最小公倍数为
,得失电子数的最小公倍数为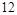 ,
,
在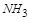 前配系数
前配系数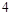 ,在
,在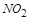 前配系数3,则
前配系数3,则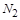 前配系数为
前配系数为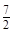 ,再配平
,再配平 ,在
,在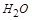 前配
前配 ;
;
即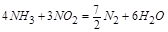
此方程式的两端同乘以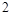 得
得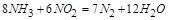
(2) 在反应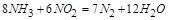 中,
中,
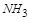 被氧化成
被氧化成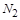 ,
,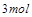
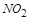 被还原
被还原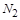 ,产物均为
,产物均为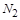 ,因而氧化产物与还原产物的质量比为
,因而氧化产物与还原产物的质量比为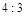 .
.
本题难度:一般
2、选择题 标准状况下,往100mL 0.2mol/L的FeBr2溶液中通入一定体积的Cl2,充分反应后,溶液中有50%的Br-被氧化。则通入的氯气的体积是(???)
A.0.224L
B.0.336L
C.0.448L
D.0.672L
参考答案:C
本题解析:
【错解分析】忽略离子还原性强弱。在氧化还原反应中,还原性(氧化性)越强的物质(或微粒)优先参与氧化还原反应。由于2Br- + Cl2=Br2 + 2Cl-,根据题意,有50%的Br-被氧化,即有0.02mol被氧化,因此通入的氯气的体积为0.224L。错选A。
【正解】由于Fe2+还原性比Br-强,当往FeBr2中通入氯气,发生的反应依次为:1)Cl2+2Fe2+=2Cl—+2Fe3+;2)Cl2+2Br—=2Cl—+Br2。因此溶液反应中反应的情况应该是:Fe2+被完全氧化并有50% Br
本题难度:一般
3、选择题 a mol Cu与含b mol HNO3的溶液恰好完全反应,被还原的HNO3的物质的量一定是(???? )
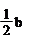
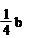
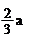
A.(b-2a) mol
B. mol
C. mol
D. mol
参考答案:A
本题解析:根据原子守恒可知,生成硝酸铜是amol,所以没有被还原的硝酸是2amol,因此被还原的硝酸是(b-2a) mol ,答案选A。
本题难度:一般
4、选择题 将SO2通入足量Fe2(SO4)3溶液中,完全反应后再加入K2CrO4溶液,发生的两个化学反应为SO2+2Fe3++2H2O=SO42-+2Fe2++W ①,Cr2O72-+aFe2++bH+
参考答案:
本题解析:
本题难度:一般
5、填空题 (10分)为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合液中进行化学处理使钢铁零件表面生成Fe3O4的致密的保护层——“发蓝”。其过程可用下列化学方程式表示: ① 3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
② ? Na2FeO2+ NaNO2+ H2O → Na2Fe2O4+ NH3↑+ NaOH
③ Na2FeO2+Na2Fe2O4+2H2O Fe3O4+4NaOH
Fe3O4+4NaOH
(1)配平化学方程式②。
(2)上述反应①中还原剂为????????,若有1mol Na2FeO2生成,则反应中有 ???mol电子转移。
(3)关于形成“发蓝”的过程,下列说法正确的是 ????????????。
A.该生产过程不会产生污染
B.反应③生成的四氧化三铁具有抗腐蚀作用
C.反应①②③均是氧化还原反应
D.反应①②中的氧化剂均为NaNO2
(4)当NaOH溶液浓度过大,“发蓝”的厚度会变小,其原因是
??? ??。
参考答案:(10分)
(1)6,1,5,3,1,7?(2分)
本题解析:
试题分析:该工艺是利用铁离子的氧化产生发蓝,提高枪支的抗腐蚀性。
由题的Fe???2+转化为Fe3+,亚铁离子被氧化失去e-,N3+转化为N3-被还原,得6e-,由化学反应电子守恒的,化学方程式为6Na2FeO2+NaNO2+5H2O=3Na2Fe2O4+NH3↑+7NaOH;
(2)还原剂为Fe???,Fe从零价到正二价,失去两个电子,所以有1mol??? Na2FeO2生成,反应中有2mol电子转移;
(3)任何生产过程都会产生一定的污染,A错误;生成四氧化三铁是为了保护枪支
本题难度:一般