微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)在①NaCl、②NaOH、③N2、④H2S、⑤Na2O2中,只含有离子键的是______,只含有极性键的是______,既含离子键又含非极性共价键的是______.
(2)写出下列物质的电子式:CO2______NaCl______ HClO______.
参考答案:(1)①NaCl为离子化合物,只含有离子键;
②NaO
本题解析:
本题难度:一般
2、填空题 掌握以下物质的电子式
N2( )NH3( )H2O( )H2O2( )
NaOH( )Na2O2( )HCl( )CH4( )
参考答案:“略”
本题解析:
本题难度:简单
3、填空题 (12分)已知周期表中,元素Q、R、W、Y与元素X相邻。Y的最高化合价氧化物的水化物是强酸。回答下列问题:
(1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是_______________;
(2)Q的具有相同化合价且可以相互转变的氧化物是_________;
(3)R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学式是 _________________;
(4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式)________________,其原因是____________________;
②电子总数相同的氢化物的化学式和立体结构分别是_________________________.;
(5)W和Q所形成的结 构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCL气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是???????????????????________
构陶瓷材料的一种合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCL气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是???????????????????________
参考答案:(1)原子晶体。(2)NO2和N2O4(3)As2S5。(4
本题解析:略
本题难度:一般
4、选择题 在下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是( )
A.CaC2+2H2O→Ca(OH)2+HC≡CH↑
B.2Na2O+2H2O=4NaOH
C.MgCl2+2NaOH=Mg(OH)2↓+2NaCl
D.2NaOH+Cl2=NaCl+NaClO+H2O
参考答案:A
本题解析:
本题难度:简单
5、填空题 (1)科学家通过X射线推测胆矾结构示意图可简单表示如下,图中虚线表示的作用力分别为????????????????????????
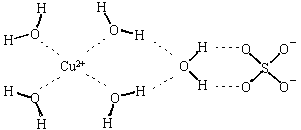
(2)在硫酸铜溶液中逐滴滴加氨水至过量,先出现蓝色沉淀,最后溶解形成深蓝色的溶液。写出此蓝色沉淀溶解的离子方程式:????????????????????????????????????;
(3)SiCl4与SO42一互为等电子体,预测SO42一的空间构型为??????????????????????????????
参考答案:(1)氢键??配位键 (6分)
(2)Cu(OH)2+
本题解析:
(1)氧原子电负性较大,与氢原子间形成氢键,中心原子铜离子有空轨道,氧原子提供孤电子对,Cu2+与O形成配位键。
(2)Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O
(3)SiCl4与SO42一互为等电子体,SiCl4中心原子Si,是sp3杂化,空间构型正四面体,等电子体结构相似,预测SO42一的空间构型正四面体。
本题难度:一般