微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在下列过程,需要加快化学反应速率的是
A.钢铁腐蚀
B.塑料老化
C.食物腐烂
D.工业炼钢
参考答案:D
本题解析:
试题分析:选项ABC应该尽可能的减缓反应速率,避免浪费。而工业炼钢应尽可能的加快反应速率,提高效率,答案选D。
点评:该题是常识性知识的考查,难度不大。有利于调动学生的学习兴趣和学习积极性,也有助于培养学生灵活运用基础知识解决实际问题的能力。
本题难度:简单
2、填空题 煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。已知:CO(g) +H2O(g) H2(g) +CO2
H2(g) +CO2
(g)的平衡常数随温度的变化如下表

试回答下列问题:
(1)上述反应的正反应是____反应(填“放热”或 “吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,正反应速率____(填“增大”、“减小” 或“不变”),容器内混合气体的压强____(填“增大”、“减小”或“不变”)。
(3)830℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进 行的有____(选填字母)。
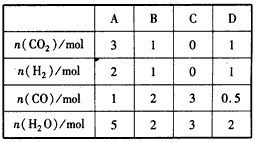
(4)830℃时,在2L的密闭容器中加入4 mol CO(g)和6 mol H2O(g)达到平衡时,CO的转化率是_______。
参考答案:(1)放热
(2)增大;增大
(3)BC
本题解析:
本题难度:一般
3、实验题 (5分)在密闭容器中投入一定量的A和B发生反应:mA(g)+nB(g)  pC(g)。
pC(g)。
(1)欲使A与B的转化率等于m:n ,则起始加入A、B的物质的量之比为????????????
(2)充入一定量的A、B,若在不同条件下C的体积分数随时间的变化如图1—1所示,则:
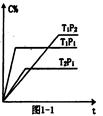
m+n???????p(填“>”、“<”或“=”),
T1 ?????T2填(“>”、“<”或“=”),
该反应的△H????0(“>”、“<”或“=”)。
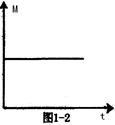
(3)一定条件下,从正反应开始达到化学平衡过程中,混和气体的平均相对分子质量随时间的变化如图1—2所示。若在恒温恒容的条件下,向原平衡体系中再通入一定量的C,则体系中气体的平均相对分子质量将???????(填“增大”、“减小”、“不变”或“无法确定”)
参考答案:(每空1分,共5分)
(1)1:1?(2)<,>,>。
本题解析:略
本题难度:简单
4、填空题 (14分)化学反应速率和限度是中学化学原理中很重要部分,根据所学知识回答下列问题:
I、用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:
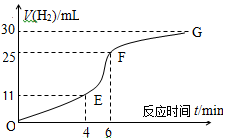
(1)实验过程如图所示,分析判断?????????段化学反应速率最快。
(2)将锌粒投入盛有稀盐酸的烧杯中,刚开始时产生H2的速率逐渐加快,其影响因素是?????????????????????????,一定时间后反应速率逐渐减慢,其原因是????????????。
(3)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是(???????? )
A.蒸馏水
B.氯化钠固体
C.氯化钠溶液
D.浓盐酸 E.降低温度
II、某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。由图中数据分析:
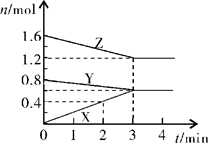
(1)该反应的化学方程式:????????????????????????????????;
(2)反应开始至2min末,X的反应速率为???????(mol·L-1·min-1);
(3)3min后图中曲线所表示的含义是??????????????????????。
参考答案:(14分) ?I、(1)EF;(2)该反应放热,体系温度升高
本题解析:I、(1)根据图像可知,EF段斜率最大,所以反应速率最快。
(2)由于该反应放热,体系温度升高,反应速率加快。但当反应进行到一定程度后,盐酸到浓度降低,此时浓度对反应速率的影响超过了温度对反应速率的影响,所以反应速率又逐渐降低。
(3)AC均是稀释,氢离子的浓度降低,反应速率降低。同样降低温度,反应速率也会降低。B对反应速率不影响,D是最大氢离子浓度,反应速率增大。答案选ACE。
II、 (1)根据图像可知,当反应达到平衡时,X的我这里增加了0.6mol,Y的物质的量减少了0.2mol,
本题难度:一般
5、选择题 一定条件下,分别对反应C(S)+CO2(g)???? 2CO(g)(正反应吸热)进行如下操作(只改变该条件):

①升高反应体系的温度;②增加反应物C的用量;
③缩小反应体系的体积;④减少体系中CO的量。
上述措施中一定能使反应的反应速率显著加快的是(??)
A.①②③④
B.①③④
C.①②
D.①③
参考答案:D
本题解析:
试题分析:增加碳的质量对反应无影响,因为它为固体,减少CO相当于减小浓度,速率降低。
本题难度:一般