微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)钡盐生产中排出大量的钡泥[主要含BaCO3、BaSO3、Ba(FeO2)2等],某主要生产BaCO3的化工厂利用钡泥制取Ba(NO3)2晶体及其他副产物,其部分工艺流程如下:
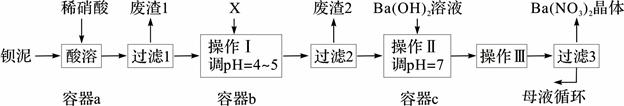
已知:i Fe(OH)3和Fe(OH)2完全沉淀时,溶液的pH分别为3.2和9.7。
ii Ba(NO3)2在热水中溶解度较大,在冷水中溶解度较小。
iii KSP(BaSO4)=1.1×10-10,KSP(BaCO3)=5.1×10-9。
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。用离子方程式和必要的文字说明提纯原理: 。
(2 )上述流程酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,化学方程式为: 。
(3)该厂结合本厂实际,选用的X为 (从下列选项中选择);废渣2为 (写出化学式)。
① BaCl2 ②Ba(NO3)2 ③BaCO3 ④ Ba(OH)2
(4)过滤3后的母液应循环到容器 中。(填“a”、“b”或“c”)
(5)称取w g晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量沉淀质量为m g,则该Ba(NO3)2的纯度为 。
参考答案:(1)BaSO4(s)+CO32-(aq) ![]()
本题解析:
试题分析:(1)在溶液中存在平衡:BaSO4(s)+CO32-(aq) 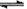 BaCO3(s)+SO42-(aq),加入饱和的碳酸钠溶液,增大碳酸根离子的浓度,使平衡正向移动生成碳酸钡而除去BaSO4杂质;
BaCO3(s)+SO42-(aq),加入饱和的碳酸钠溶液,增大碳酸根离子的浓度,使平衡正向移动生成碳酸钡而除去BaSO4杂质;
(2)Ba(FeO2)2与HNO3反应生成两种硝酸盐,则根据原子守恒两种硝酸盐应该是硝酸铁和硝酸钡,同时还有水生成,反应的化学方程式为Ba(FeO2)2+8HNO3 = Ba(NO3)2+2Fe(NO3)3+4H2O;
(3)X是调节溶液pH,以沉淀溶液中的铁离子,由于不能引入杂质,实验根据本长的实际应该选择碳酸钡,答案选③;氢氧化铁在pH=3.2时就已经完全沉淀,则滤渣2的主要成分是Fe(OH)3(2分);(4)过滤3后的母液中含有氢氧化钡,因此应循环到容器c中;
(5)mg沉淀应该是硫酸钡,则碳酸钡的质量是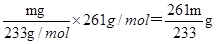 ,所以其纯度为
,所以其纯度为 ×100%。
×100%。
考点:考查物质制备工艺流程图的分析与应用
本题难度:困难
2、选择题 已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010mol?L-1,向该溶液中逐滴加入0.010 mol?L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
A.Cl-、Br-、CrO42-
B.CrO42-、Br-、Cl-
C.Br-、Cl-、CrO42-
D.Br-、CrO42-、Cl-
参考答案:C
本题解析:
试题分析:根据溶度积规则知,析出AgCl沉淀时溶液中
c(Ag+)= Ksp(AgCl)/ c(Cl?)=1.56×10?10/0.01mol/L=1.56×10-8mol/L;析出AgBr沉淀时溶液中c(Ag+)= Ksp(AgBr)/ c(Br?)=7.7×10?13/0.01mol/L=7.7×10-11mol/L;析出Ag2CrO4沉淀时溶液中c(Ag+)=[ Ksp(Ag2CrO4)/ c(CrO42?)]1/2=3×10-5 mol/L,c(Ag+)越小,则越先生成沉淀,所以种阴
本题难度:一般
3、简答题 NiSO4-6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有Cu、Zn、Fe、Cr等杂质)为原料获得.操作步骤如下:
①用稀硫酸溶液溶解废渣,保持pH约1.5,搅拌30min,过滤.
②向滤液中滴入适量的Na2S,除去Cu2+、Zn2+,过滤.
③保持滤液在40℃左右,用6%的H2O2氧化Fe2+,再在95℃加入NaOH调节pH,除去铁和铬.
④在③的滤液中加入足量Na2CO3溶液,搅拌,得NiCO3沉淀.
⑤______.
⑥______.
⑦蒸发、冷却结晶并从溶液中分离出晶体.
⑧用少量乙醇洗涤并凉干.
(1)步骤②除可观察到黑色沉淀外,还可嗅到臭鸡蛋气味,用离子方程式说明气体的产生:______.
(2)步骤③中,加6%的H2O2时,温度不能过高,其原因是______.
(3)除铁方法有两种,一是用H2O2作氧化剂,控制pH在2~4范围内生成氢氧化铁沉淀;另一种方法常用NaClO3作氧化剂,在较小的pH条件下水解,最终生成一种浅黄色的黄铁矾钠[Na2Fe6(SO4)4(OH)12]沉淀除去.右图是温度-pH与生成的沉淀关系图,图中阴影部分是黄铁矾稳定存在的区域(已知25℃时,Fe(OH)3的Ksp=2.64×10-39).
下列说法正确的是______(选填序号).
a.FeOOH中铁为+2价
b.若在25℃时,用H2O2氧化Fe2+,再在pH=4时除去铁,此时溶液中c(Fe3+)=2.64×10-29
c.用氯酸钠在酸性条件下氧化Fe2+离子方程式为6Fe2++Cl
O
-3
+6H+═6Fe3++Cl-+3H2O
d.工业生产中温度常保持在85℃~95℃生成黄铁矾钢,此时水体的pH约为1.2~1.8
(4)确定步骤④中Na2CO3溶液足量,碳酸镍已完全沉淀的简单方法是______.
(5)补充上述步骤⑤和⑥(可提供的试剂有6mol/L的H2SO4溶液、蒸馏水、pH试纸).
参考答案:(1)滴入适量的Na2S,生成臭鸡蛋气味气体,应为H2S,反
本题解析:
本题难度:一般
4、选择题 在盛有AgCl沉淀的试管中加入KI溶液,振荡后可观察白色沉淀逐渐变为黄色沉淀。通过这个实验可以说明的是
[???? ]
A.I-的还原性比Cl-的强
B.Cl-的半径比I-的小
C.AgI的溶解度比AgCl的大
D.实验过程中,溶解平衡AgCl(s)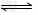 Ag+(aq)+Cl-(aq)不断向右移动
Ag+(aq)+Cl-(aq)不断向右移动
参考答案:D
本题解析:
本题难度:一般
5、选择题 下列化学实验事实及其解释或结论都正确的是(????)
A.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+
B.用乙醇、冰醋酸及pH=0的H2SO4加热可制乙酸乙酯,用饱和的Na2CO3溶液可以洗去其中含有的乙醇和乙酸,说明乙酸乙酯在Na2CO3溶液中的溶解度很小
C.向浓度均为0.1 mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,首先生成蓝色沉淀,说明Ksp[Cu(OH)2] >Ksp[Mg(OH)2]
D.配制0.10mol/L NaCl溶液,俯视容量瓶的刻度线定容,所配溶液浓度偏大
参考答案:D
本题解析:
试题分析:A、取少量溶液X,向其中加入适量新制氯水,若有Fe2+,已经被氧化为Fe3+,再加KSCN溶液,溶液变红,不能说明原溶液中有Fe2+,错误;B、用乙醇、冰醋酸及浓H2SO4加热才可以制乙酸乙酯,错误;C、向浓度均为0.1 mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,若先生成蓝色沉淀,说明氢氧化铜的溶度积常数小,错误;D、配制溶液,俯视刻度线,体积变小,浓度偏大,正确。
本题难度:一般