微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知25 ℃ 时,BaCO3的溶度积Ksp=2.58×10-9,BaSO4的溶度积Ksp=1.07×10-10,则下列说法不正确的是
A.温度一定时,当溶液中c(Ba2+)×c(SO42-)=1.07×10-10时,此溶液为BaSO4的饱和
溶液
B.因为Ksp(BaCO3)>Ksp(BaSO4),所以无法将BaSO4转化为BaCO3
C.25 ℃ 时,在未溶解完BaCO3的饱和溶液中滴入少量Na2SO4溶液后有BaSO4沉淀析
出,此时溶液中c(CO32-)∶c(SO42-)=24.11
D.在饱和BaCO3溶液中加入少量Na2CO3固体,可使c(Ba2+)减小,BaCO3的溶度积不变
参考答案:B
本题解析:根据溶度积常数的概念可知A正确。能否生成碳酸钡沉淀,关键是溶液中c(Ba2+)×c(CO32-)>2.58×10-9,与溶度积常数大小并没有直接的关系,B不正确。BaCO3的溶度积Ksp=c(Ba2+)×c(CO32-),BaSO4的溶度积Ksp=c(Ba2+)×c(SO42-),因为是在相同的溶液中,所以二者多的溶度积常数的比值就是c(CO32-)∶c(SO42-)=2.58×10-9/1.07×10-10=24.11,C正确。根据平衡移动原理可知,增大c(CO32-),可使平衡向结晶的方向移动,所以c
本题难度:一般
2、实验题 类比是一种重要的科学研究方法。某化学实验小组类比AgOH能溶于氨水的性质,猜测Cu(OH)2也具有同样的性质,并对此进行实验探究:
(1)写出AgOH与氨水反应的离子方程式_____________________________________。
(2)甲组同学进行如下操作:向干燥洁净的试管中加入CuSO4溶液,再向其中逐滴加入氨水,观察到蓝色沉淀生成;继续滴加,观察现象,由此得出Cu(OH)2可溶于氨水的结论。
①写出生成蓝色沉淀的离子方程式:_______________________________________________
②写出向沉淀中滴加氨水的实验现象:______________________________________________
(3)乙组同学向CuSO4溶液中滴加NaOH溶液,制得Cu(OH)2悬浊液A,向其中加入足量氨水,始终未观察到(2)中的现象。甲乙两组同学在对他们的实验及现象进行比对后,决定对Cu(OH)2与氨水反应的机理进行探究:
①该实验小组的同学取一定量上述制得的Cu(OH)2悬浊液A,向其中加入足量饱和NH4Cl溶液,结果观察到(2)中现象。据此,有同学认为由于饱和NH4Cl溶液的加入引入了Cl—,致使Cu(OH)2与氨水的反应得以发生,而指导老师表示这一观点是不成立的。为了排除Cl—的干扰,该组同学又做了如下实验:取一定量上述制得的Cu(OH)2悬浊液A,向其中加入饱和___________溶液(填化学式),结果同样观察到(2)中的现象,据此可知该反应的发生与Cl—无关。
②因此,同学们又提出:Cu(OH)2与氨水的反应的发生需要NH4+的参与,于是同学们进一步探究:向干燥洁净的试管中加入CuSO4溶液,再向其中逐滴加入氨水,观察到蓝色沉淀生成。通过离心的方法得到Cu(OH)2沉淀。将沉淀洗涤后,置于干燥洁净的试管中,向试管中滴加足量饱和氨水,为观察到(2)中现象,再向试管中滴加足量饱和NH4Cl溶液,观察到(2)中现象。
(i)检验是否沉淀洗涤干净的操作是___________________________________________
(ii)据此,可以得出结论:在Cu(OH)2与氨水的反应中,NH4+起着至关重要的作用,且________________对反应的发生有影响。
(4)试从溶解平衡角度解释上述反应发生过程中NH4+的作用:___________________________。
参考答案:
(1)AgOH+2NH3·H2O=Ag(NH3)2+
本题解析:
试题分析:(1)向AgOH中滴加氨水会生成银氨络合离子。
(2)①蓝色沉淀为氢氧化铜。②蓝色沉淀逐渐溶解,因此生成的铜氨络合离子。
(3)①为排除其他离子的干扰,可加入(NH4)2SO4。
②(i)该沉淀中可能含有的杂质离子是硫酸根,因此检验硫酸根即可。
(ii)从实验操作看,用的是饱和溶液,因此NH4+的浓度对反应也有影响。
(4)实验过程中存在的平衡有:Cu(OH)2 本题难度:一般
本题难度:一般
3、填空题 已知Ksp(PbCrO4)=2.8×10-13 mol2·L-2, Ksp(CaCrO4) =7.1×10-4 mol2·L-2,向Pb2+ 、Ca2+的混合溶液
(Pb2+ 、Ca2+的浓度均为0. 10 mol·L-1)中滴加K2 CrO4溶 液,则出现沉淀的次序为__________。
参考答案:PbCrO4,CaCrO4
本题解析:
本题难度:一般
4、填空题 在氯化铁溶液中存在下列平衡:FeCl3+3H2O Fe(OH)3+3HC1;△H>0。回答下列问题:
Fe(OH)3+3HC1;△H>0。回答下列问题:
(1)加热FeCl3溶液,溶液的颜色会不断加深,可得到一种红褐色透明液体,向这种液
体中加入MgCl2溶液,产生的现象为 。
(2)不断加热FeCl3溶液,蒸干其水分并灼烧得到的固体可能是 。
(3)在配制FeCl3溶液时,为防止浑浊,应加入 。
(4)为了除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入MgCO3固体,过滤
后再加入足量盐酸。MgCO3固体能除去Fe3+的原因是 。
参考答案:(1)生成红褐色沉淀 &#
本题解析:
试题分析:(1)MgCl2是电解质,可使胶体聚沉,所以会产生红褐色沉淀。
(2)Fe(OH)3失水得到Fe2O3。
(3)在FeCl3溶液中加入浓盐酸使Fe3+水解平衡左移,防止反应FeCl3+3H2O Fe(OH)3+3HC1发生,产生Fe(OH)3。
Fe(OH)3+3HC1发生,产生Fe(OH)3。
(4)氯化铁和碳酸镁的水解互相促进。即MgCO3与Fe3+水解产生的H+反应,促进了Fe3+水解,使Fe3+转化为Fe(OH)3沉淀而除去。
考点:本题考差了水解,沉淀溶解平衡等相关知识。
本题难度:一般
5、选择题 常温下Ca(OH)2溶于水达饱和时存在如下平衡:??Ca(OH)2(s)?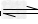 ?Ca(OH)2(aq), Ca(OH)2(aq)==Ca2+ +2OH-?饱和石灰水的密度为d?g/cm3,溶液的pH=12。则该温度下Ca(OH)2的溶解度为[???? ]
?Ca(OH)2(aq), Ca(OH)2(aq)==Ca2+ +2OH-?饱和石灰水的密度为d?g/cm3,溶液的pH=12。则该温度下Ca(OH)2的溶解度为[???? ]
A.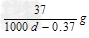 ???
???
B.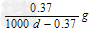 ?????
?????
C.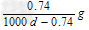 ????
????
D. ?
?
参考答案:A
本题解析:
本题难度:一般