微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一定条件下,将1mol的CO和1mol水蒸气通入容器中发生下述反应:
CO+H2O CO2+H2,达到平衡后,测得CO2为0.6mol,再通入0.4mol水蒸气,又达到平衡后,CO2的物质的量为
CO2+H2,达到平衡后,测得CO2为0.6mol,再通入0.4mol水蒸气,又达到平衡后,CO2的物质的量为
A.等于0.6mol
B.等于1mol
C.大于0.6mol且小于1mol
D.大于1mol
参考答案:C
本题解析:增大水蒸气的浓度,平衡向正反应方向移动,通过CO的转化率,所以平衡时CO2的物质的量大于0.6mol。但由于是可逆反应,所以转化率达不到100%,因此CO2的浓度小于1.0mol。答案选C。
本题难度:一般
2、选择题 已知4NH3+5O2?4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,正确的关系是( )
A.4?v(NH3)=5v(O2)
B.6?v(O2)=5v(H2O)
C.4v(NH3)=6?v(H2O)
D.5v(O2)=4v(NO)
参考答案:B
本题解析:
本题难度:简单
3、选择题 一密闭体系中发生反应:2SO2(g)+O2(g) 2SO3(g),下图表示该反应的速率(v)在某一时间(t)段内的变化。则下列时间段中,SO3的百分含量最高的是
2SO3(g),下图表示该反应的速率(v)在某一时间(t)段内的变化。则下列时间段中,SO3的百分含量最高的是
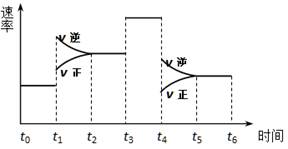
A.t0→t1
B.t2→t3
C.t3→t4
D.t5→t6
参考答案:A
本题解析:
试题分析:观察图中所示,B、C项:化学平衡逆向移动,SO3的百分含量减少,故错。故选A。
点评:本题考查的是化学平衡的移动的相关知识,题目难度不大,学习中注意相关基础知识的积累,此类题目可轻松解答。
本题难度:简单
4、计算题 (6分)一定温度下,在2L密闭容器中充入N2和H2合成NH3,其起始浓度分别为:c(N2)=2mol/L,c (H2 ) =3mol/L,此时压强为5.05×105Pa, 达平衡后测得NH3占总体积的25%。(1)求平衡时的压强;(2)平衡时混合气体对H2的相对密度。???
参考答案:(1) 4.04 ×105?Pa????(2)7.75
本题解析:N2(g)+3H2(g) 2NH3(g)
2NH3(g)
4mol?? 6mol???????? 0
a???? 3a????????????? 2a
4--a???? 6---3a?????????? 2a
2a/(10-2a)×100%=25%??? a==1mol
P1:P2===N1:N2????P1==5.05×105Pa??
N1==10mol???????????N2==8mol???? P2==4.04×105Pa
M混==(4mol ×28g/mol+ 6mol ×2g/mol)/8mol ===15.5g/mol
D====7.75
本题难度:一般
5、选择题 在一固定容积的密闭容器中,充入3mol?A?和1mol?B,发生反应:3A(g)+B(g)?xC(g),达平衡后,C的浓度为a?mol/L,若维持容器体积和温度不变,以0.6mol?A、0.2mol?B和1.6mol?C为起始物质,达到平衡后,C的浓度也为a?mol/L,则x的值为( )
A.1
B.2
C.3
D.4
参考答案:恒温恒容下,开始充入3molA和1molB与开始充入0.6m
本题解析:
本题难度:简单