微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)
(1)向Na2CO3的浓溶液中逐滴加入稀盐酸,直到不再生成CO2气体为止,则在此过程中,溶液的c(HCO)变化趋势可能是:①逐渐减小;②逐渐增大;③先逐渐增大,而后减小④先逐渐减小,而后增大。4种趋势中可能的是________。
(2)pH相同的HCl溶液、H2SO4溶液、CH3COOH溶液各100 mL。
①3种溶液中,物质的量浓度最大的是________。
②分别用0.1 mol·L-1的NaOH溶液中和,其中消耗NaOH溶液最多的是________。
③与等量的锌粉反应,反应开始时,反应速率________。
A.HCl最快
B.H2SO4最快
C.CH3COOH最快
D.一样快
参考答案:(1)③???(2)①CH3COOH??②CH3COOH??
本题解析:(1)碳酸钠和盐酸反应是分步进行的,即Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑,所以答案选③。
(2)①盐酸是一元强酸,硫酸是二元强酸,醋酸是一元弱酸,所以在pH相等的条件小,醋酸的浓度大。
②醋酸浓度大,则消耗的氢氧化钠也多。
③反应开始时,氢离子浓度是相同的,所以反应速率相同,答案选D。
本题难度:一般
2、选择题 反应:L(s)+aG(g)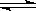 bR(g)?达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断(???)
bR(g)?达到平衡时,温度和压强对该反应的影响如图所示:图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断(???)

A.上述反应 △H<0
B.上述反应△H>0
C.a>b
D.a<b
参考答案:BD
本题解析:
试题分析:反应:L(s)+aG(g)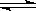 bR(g) 图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数,看等温线,随着压强增大,平衡向体积减小的方向移动,G的体积分数减小,说明平衡向正反应方向移动,即a<b;看等压线p1或p2,随着温度升高,平衡向吸热方向移动,G的体积分数减小,说明平衡向正反应方向移动,即△H>0,故选B D。
bR(g) 图中压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数,看等温线,随着压强增大,平衡向体积减小的方向移动,G的体积分数减小,说明平衡向正反应方向移动,即a<b;看等压线p1或p2,随着温度升高,平衡向吸热方向移动,G的体积分数减小,说明平衡向正反应方向移动,即△H>0,故选B D。
点评:在此总结一下对于化学平衡的有关图象问题的分析方法:
(1)认清坐标系,搞清纵、横坐标所代表的意义,并与勒夏特列原理挂钩。
(2)紧扣可逆反应的特征,看清正反应方向是吸热还是放热、体积增大还是减小、不变、有无固体、纯液体物质参加或生成等。
(3)看清速率的变化及变化量的大小,在条件与变化之间搭桥。
(4)看清起点、拐点、终点,看清曲线的变化趋势。
(5)先拐先平,数值大。例如,在转化率一时间图上,先出现拐点的曲线先达到平衡,此时逆向推理可得该变化的温度高、浓度大、压强高。
(6)定一议二。当图象中有三个量时,先确定一个量不变再讨论另外两个量的关系
本题难度:简单
3、选择题 FeCl3溶液中滴加KSCN溶液变血红色,是因为发生了下列反应,FeCl3+3KSCN Fe(SCN)3+3KCl,向该平衡体系中加入少量KCl固体,红色将(???)
Fe(SCN)3+3KCl,向该平衡体系中加入少量KCl固体,红色将(???)
A.变浅
B.变深
C.不变
D.无法确定
参考答案:C
本题解析:
试题分析:反应的实质是Fe3++3SCN- Fe(SCN)3,可以看到K+、Cl-没有参加反应,加入少量KCl固体平衡不移动,故选C。
Fe(SCN)3,可以看到K+、Cl-没有参加反应,加入少量KCl固体平衡不移动,故选C。
点评:本题考查的是化学平衡的知识,学生需要注意的是抓住化学反应的本质,是解得本题的关键。
本题难度:简单
4、选择题 在一密闭容器中,反应mA(g)+nB(g) pC(g)达到平衡时,测得c(A)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3 mol·L-1。则下列判断正确的是(?? )
pC(g)达到平衡时,测得c(A)为0.5 mol·L-1;在温度不变的条件下,将容器体积扩大一倍,当达到平衡时,测得c(A)为0.3 mol·L-1。则下列判断正确的是(?? )
A.化学计量数:m+n<p?????????????????? B.平衡向正反应方向移动了
C.物质B的转化率减小了?????????????? D.物质C的质量分数增加了
参考答案:C
本题解析:将容器的体积扩大一倍,若平衡不发生移动,则A的浓度应为0.25 mol·L-1,现在为0.3 mol·L-1,说明平衡向逆反应方向移动了,B错;将容器的体积扩大一倍,相当于减小压强,平衡向逆反应方向移动,说明逆反应为气体体积增加的反应,所以m+n>p,A错;因为平衡向逆反应方向移动,B的转化率减小,C的质量分数减少,C对;D错
本题难度:一般
5、选择题 某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)  ?2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中各物质的物质的量浓度、反应速率分别随时间的变化如下图所示:
?2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中各物质的物质的量浓度、反应速率分别随时间的变化如下图所示:
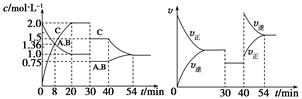
下列说法中正确的是
A.30~40 min该反应使用了催化剂
B.反应方程式中的x=1,正反应为吸热反应
C.30 min时降低压强,40 min时升高温度
D.8 min时反应第一次达到平衡
参考答案:C
本题解析:
试题分析: 30~40 min时,正逆反应速率都减小,但平衡没有发生移动,只可能是改变压强和使用催化剂,而使用催化剂,A、B、C的浓度不会突然改变,只有减小压强,故A错误;单位时间内消耗A、B的浓度相同,所以x=1,40 min时C的浓度减小,A、B的浓度增大,而正逆反应速率都增大,平衡左移,只能是升温,正反应为放热反应。所以B错,C正确;8 min时,A、B、C的浓度相等,但还在改变,并未达到平衡,故D错。
本题难度:一般