微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 能影响水的电离平衡,并使溶液中c(H+)>c(OH-)的措施是
A.将水加热煮沸,测得pH=6
B.向纯水中投入一小块金属钠
C.向水中加入NH4Cl固体
D.向水中加入Na2CO3固体
参考答案:C
本题解析:A?将水加热煮沸,虽然pH=6,但成中性,c(H+)=c(OH-)
B 2Na+2H2O=2NaOH+H2溶液成碱性 c(H+)<c(OH-)
C 向水中加入NH4Cl固体? NH4+水解显酸性c(H+)>c(OH-)
D 向水中加入Na2CO3固体,CO32-水解,溶液显碱性 c(H+)<c(OH-)
本题难度:困难
2、填空题 373K时,某 1L密闭容器中加入1molPCl5发生如下可逆反应: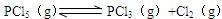 其中物质PCl3的物质的量变化如右图所示。
其中物质PCl3的物质的量变化如右图所示。
(1 )前 20
)前 20 s内 PCl5(g)的平均反应速率为??????
s内 PCl5(g)的平均反应速率为??????
(2)373K时该反应的平衡常数的值为???????
(3)若在此平衡体系中再加入 1mol的 PCl5,与原平衡比较,新平衡时 PCl5的转化率???(填“增大”或“减小”,下同)。PCl5的平衡浓度???????????????????。
(4)将原平衡升温至 473K,重新达平衡时(其他条件不变),PCl3的平衡浓度为 PCl5的3倍,该反应的正反应为(填“放热反应”或 “吸热反应”)????????,为增大平衡体系中 Cl2的物质的量,下列措施正确的是(其它条件相同)?????
a.升高温度???????????????????????????? b.扩大容器的体积
c.加入合适的催化剂???????????????????? d.再充入 PCl3
参考答案:(1) 0 本题解析:略
本题解析:略
本题难度:简单
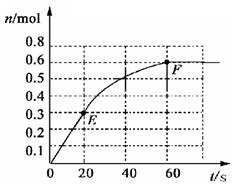
3、选择题 下列化学反应中,为使平衡体系析出更多的银,可采取的措施是Ag++Fe2+ Ag(固)+Fe3+(正反应放热)
Ag(固)+Fe3+(正反应放热)
A常温下加压 B增加Fe3+的浓度
C增加Fe2+的浓度 D移去一些析出的银
参考答案:C
本题解析:略
本题难度:一般
4、填空题 (15分)氨是最重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国人哈伯在1905年发明的,其合成原理为:N2(g)+3H2(g) 2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:
2NH3(g);△H<0他因此获得了1918年诺贝尔化学奖。工业上合成氨的部分工艺流程如下:
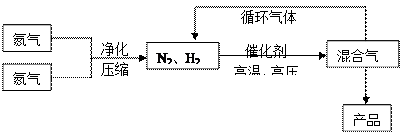
气体
| 氮气
| 氢气
| 氨
|
熔点(℃)
| -210.01
| -252.77
| -77.74
|
沸点(℃)
| -1 95.79 95.79
| -259.23
| -33.42
????????????????????????????????????????????????????????????????????????????????????
反应体系中各组分的部分性质见上表:
(1)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度降低到??????????℃使混合气体分离出来产品;继续循环的气体是???????????????。
(2)工业上采取用上述 (1)操作的目的:??????????????????????????? (1)操作的目的:???????????????????????????
????????????????????????????????????????????????????????????????????????。
(3)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________??????。
(4)合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应: N2(g)+3H2(g) 2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是 2NH3(g),在673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是
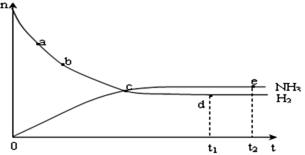
A.点a的正反应速率比点b的大
B.点 c处反应达到平衡
C.点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻, n(H2)比上图中d点的值大???
参考答案:
 本题解析:略 本题解析:略
本题难度:一般
5、选择题 一定温度下,在固定体积的密闭容器中进行反应:N2+3H2 2NH3。该反应达到平衡的标志是 2NH3。该反应达到平衡的标志是
A.3v(H2)正=2v(NH3)逆
B.单位时间生成m mol N2的同时生成3m mol H2
C.混合气体的密度不再随时间变化
D.容器内的总压强不再随时间而变化
参考答案:D
本题解析:略
本题难度:一般
|