微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列物质中,属于弱电解质的是
A.酒精
B.二氧化硫
C.一水合氨
D.硫酸钡
参考答案:C
本题解析:弱酸、弱碱及水一般为弱电解质,故答案为C,而AB为非电解质,D为强电解质
本题难度:简单
2、选择题 用食用白醋(醋酸浓度约1 mol/L)做下列实验,能证明醋酸为弱电解质的是[???? ]
A.白醋中滴入石蕊试液呈红色
B.白醋加入豆浆中有沉淀产生
C.蛋壳浸泡在白醋中有气体放出
D.pH试纸显示白醋的pH为2~3
参考答案:D
本题解析:
本题难度:一般
3、选择题 常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液,有关微粒的物质的量变化如下图(其中I代表H2A,II代表HA-,III代表A2-)。
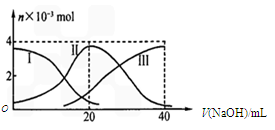
根据图示判断,下列说法正确的是
A.当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
B.等体积等浓度的NaOH溶液与H2A溶液混合,其溶液中水的电离程度比纯水的大
C.向Na2A溶液加入水的过程中,pH可能增大也可能减小
D.NaHA溶液中:c(OH-)+c(A2-) = c(H+)+c(H2A)?
参考答案:AD
本题解析:
试题分析:A、此时物质恰好反应生成NaHA,图中读出c(HA-)>c(A2-)> c(H2A)知NaHA电离大于水解,以电离为主,故有c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),正确;B、此时同A选项,NaHA电离溶液为酸性抑制水的电离,错误;C、Na2A溶液水解呈碱性,加水稀释离子浓度减少,pH减小,错误;D、质子守恒,正确。
本题难度:一般
4、选择题 pH相同的醋酸溶液和盐酸,分别用蒸馏水稀释至原体积的m倍和n倍,稀释后两溶液pH仍相同,则m和n的关系是( )
A.m=n
B.m>n
C.m<n
D.无法判断
参考答案:B
本题解析:pH相同的醋酸溶液和盐酸,分别用蒸馏水稀释至相同倍数时,由于醋酸时弱电解质,醋酸的PH比盐酸的PH小,现在稀释后两溶液pH仍相同,醋酸放的水应该多一些,故m>n,选B。
本题难度:一般
5、选择题 常温下测得浓度均为0.1 mol·L—1的下列三种溶液的pH:
溶 质
| NaHCO3
| Na2CO3
| NaCN
|
pH
| 8.4
| 11.6
| 11.1
?
下列说法中错误的是
A.溶液中阳离子物质的量之和的关系为:Na2CO3>NaHCO3=NaCN
B.相同条件下的酸性:H2CO3>HCN
C.三种溶液中均存在电离平衡和水解平衡
D.升高Na2CO3溶液的温度会使c(HCO3—)/ c(CO32—)增大
参考答案:A
本题解析:
试题分析:A、溶液中阳离子物质的量之和,因三种溶液的体积不确定,无法比较物质的量的大小,错误;B、根据“越弱越水解”盐的水解规律,NaCN水解程度大于NaHCO3水解程度,所以酸性:H2CO3>HCN,正确;C、都存在水的电离平衡以及相应的弱酸根离子的水解平衡,正确;D、升高温度促进Na2CO3水解,平衡正向移动,会使c(HCO3—)/ c(CO32—)增大,正确。
本题难度:一般
|